कक्षा 10 विज्ञान अध्याय 2 एनसीईआरटी समाधान – अम्ल, क्षारक एवं लवण
कक्षा 10 विज्ञान अध्याय 2 के लिए एनसीईआरटी समाधान पाठ 2 अम्ल, क्षारक एवं लवण अभ्यास में दिए गए प्रत्येक प्रश्न के उत्तर तथा पाठ के बीच बीच में अधिकतर पेज पर दिए गए सवाल जवाब विद्यार्थी यहाँ से निशुल्क प्राप्त कर सकते हैं। वर्ग 10 विज्ञान पाठ 2 के समाधान सीबीएसई सत्र 2025-26 के लिए संशोधित किए गए हैं। प्रत्येक प्रश्न को सरल भाषा में चित्रों के साथ पस्तुत किया गया है। न केवल सीबीएसई बल्कि यूपी एमपी बिहार उत्तराखंड आदि बोर्ड में पढ़ने वाले छात्रों को ध्यान में रखकर कक्षा 10 विज्ञान अध्याय 2 के समाधान तैयार किए गए हैं। ऑफलाइन पढ़ने के लिए आप कक्षा 10 विज्ञान समाधान ऐप डाउनलोड कर सकते हैं।
कक्षा 10 विज्ञान अध्याय 2 के लिए एनसीईआरटी समाधान
कक्षा 10 विज्ञान अध्याय 2 के लिए एनसीईआरटी समाधान नीचे दिए गए हैं:
कक्षा 10 विज्ञान अध्याय 2 के बहुविकल्पीय प्रश्न (MCQ) उत्तर
एक जलीय विलयन लाल लिटमस विलयन को नीला कर देता है। निम्नलिखित में से किसके विलयन को आधिक्य में मिलाने पर यह परिवर्तन व्युत्क्रमित हो जाता है?
सोडियम कार्बोनेट क्षारकीय लवण है। क्योंकि यह लवण है
एक आर्द्र दिन में हाइड्रोजन क्लोराइड गैस के विरचन के दौरान गैस को सामान्यत: कैल्सियम क्लोराइड युक्त रक्षित नली में से गुजारा जाता है। रक्षित नली में लिए गए कैल्सियम क्लोराइड का कार्य है
एक विद्यार्थी के हाथ पर दुर्घटनावश सांद्र अम्ल की कुछ बूँदें गिर जाती हैं। उसे क्या करना चाहिए?
कक्षा 10 विज्ञान अध्याय 2 के महत्वपूर्ण प्रश्न उत्तर
आपको तीन परखनलियाँ दी गई हैं। इनमें से एक में आसवित जल एवं शेष दो में से एक में अम्लीय विलयन तथा दूसरे में क्षारीय विलयन है। यदि आपको केवल लाल लिटमस पत्र दिया जाता है तो आप प्रत्येक परखनली में रखे गए पदार्थो की पहचान कैसे करेंगे?
अगर लाल लिटमस पेपर का रंग नीले रंग में बदल जाता है, तो यह एक क्षार है और अगर कोई रंग परिवर्तन नहीं होता है, तो यह या तो अम्लीय या आसवित जल है। इस प्रकार, क्षार विलयन की आसानी से पहचान की जा सकती है।
A, B और C के रूप में तीन परखनलियों को चिह्नित करें। A में से विलयन की एक बूंद लाल लिटमस पेपर पर डालते हैं। विलयन B और C के साथ भी यही दोहराते हैं। यदि इनमें से कोई भी लाल रंग को नीले रंग में परिवर्तित करता है, तो यह क्षार है। इसप्रकार, तीन में से, एक की पहचान हो गई है।
शेष दो में से कोई भी अम्लीय या आसवित जल हो सकता है। अब क्षार विलयन की एक बूंद शेष दो विलयनों में से प्रत्येक की एक बूंद के साथ मिश्रित करते हैं और फिर मिश्रण की बूंदों की प्रकृति की जांच करते हैं। अगर मिश्रण का रंग नहीं बदलता है, तो दूसरा दूसरा विलयन आसवित जल है और अगर रंग में कोई परिवर्तन होता है, तो दूसरा विलयन अम्लीय है। क्योंकि अम्लीय और क्षारीय विलयन एक-दूसरे को बेअसर कर देते हैं।
इसप्रकार, हम तीन प्रकार के विलयनों के बीच भेद कर सकते हैं।
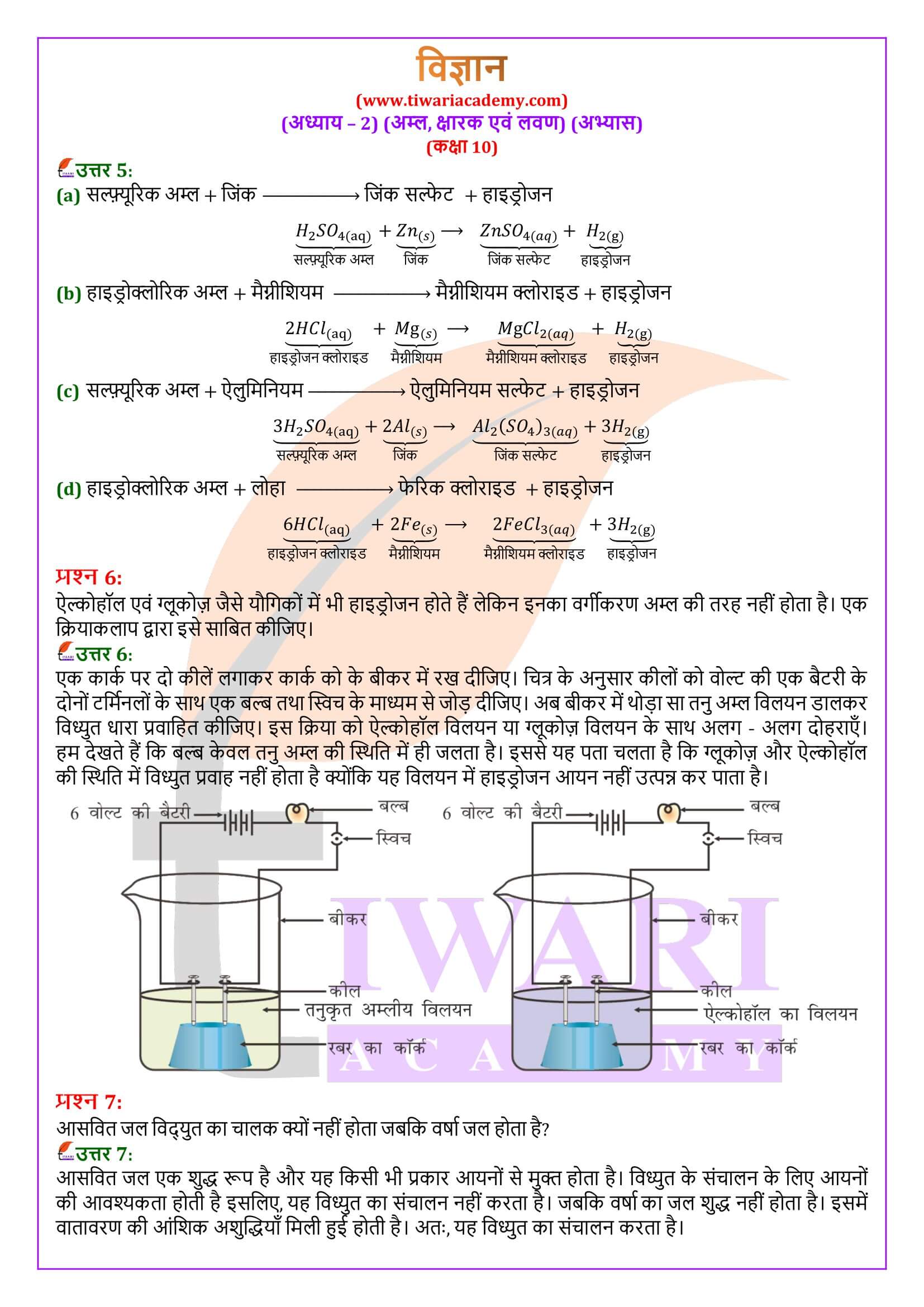
आसवित जल विद्युत का चालक क्यों नहीं होता जबकि वर्षा जल होता है?
आसवित जल एक शुद्ध रूप है और यह किसी भी प्रकार आयनों से मुक्त होता है। विध्युत के संचालन के लिए आयनों की आवश्यकता होती है इसलिए, यह विध्युत का संचालन नहीं करता है। जबकि वर्षा का जल शुद्ध नहीं होता है। इसमें वातावरण की आंशिक अशुद्धियाँ मिली हुई होती है। अतः, यह विध्युत का संचालन करता है।
जल की अनुपस्थिति में अम्ल का व्यवहार अम्लीय क्यों नहीं होता है?
अम्ल जलीय विलयन में विघटित होकर हाइड्रोजन आयन (H^+ ) उत्पन्न करते हैं जो उनकी अम्लीयता के अभिलक्षण को प्रदर्शित करते हैं। जल की अनुपस्थिति के कारण हाइड्रोजन आयन उत्पन्न नहीं हो पाते हैं। इसलिए जल की अनुपस्थिति में अम्ल का व्यवहार अम्लीय नहीं होता है।
धोने का सोडा एवं बेकिंग सोडा के दो-दो प्रमुख उपयोग बताइए।
धोने का सोडा के दो प्रमुख उपयोग
इसका उपयोग काँच, साबुन तथा कागज उद्योगों में होता है।
इसका उपयोग घरों में साफ – सफाई के लिए होता है।
बेकिंग सोडा के दो प्रमुख उपयोग
इसका उपयोग सोडा – अम्ल अग्निशामक में भी किया जाता है।
इसका उप्गोग खाने की चीजों को मुलायम तथा स्पंजी बनाने के लिए किया जाता है।
आपके पास दो विलयन ‘A’ एवं ‘B’ हैं। विलयन ‘A’ के pH का मान 6 है एवं विलयन ‘B’ के pH का मान 8 है। किस विलयन में हाइड्रोजन आयन की सांद्रता अधिक है? इनमें से कौन अम्लीय है तथा कौन क्षरकीय?
यदि विलयन के pH का मान 7 से अधिक है तो वह क्षारीय है और यदि pH का मान 7 से कम है तो वह अम्लीय है। इसलिए विलयन ‘A’ अम्लीय है और विलयन ‘B’ क्षारीय है। अम्लीय विलयन में हाइड्रोजन आयन की सांद्रता अधिक होती है इसलिए विलयन ‘A’ में हाइड्रोजन आयन की सांद्रता अधिक है।
कोई किसान खेत की मृदा की किस परिस्थिति में बिना बुझा हुआ चूना (कैल्सियम ऑक्साइड), बुझा हुआ चूना (कैल्सियम हाइड्रॉक्साइड) या चॉक (कैल्सियम कार्बोनेट) का उपयोग करेगा?
यदि खेत की मृदा अम्लीय है तो वह खेती योग्य नहीं होती है। खेत में अम्लीयता को कम करने के लिए उसमे क्षार मिलाया जाता है। यहाँ किसान बिना बुझा हुआ चूना (कैल्सियम ऑक्साइड), बुझा हुआ चूना (कैल्सियम हाइड्रॉक्साइड) या चॉक (कैल्सियम कार्बोनेट) का उपयोग कर रहा है अर्थात उसके खेत की मृदा अम्लीय है।
अम्ल का जलीय विलयन क्यों विद्युत का चालन करता है?
जलीय विलयन में विद्युत धारा का प्रवाह आयनों द्वारा होता है। अम्ल जलीय विलयन में हाइड्रोजन आयन (H⁺) उत्पन्न करता है। इसी कारण अम्ल का जलीय विलयन विद्युत का चालन करता है।
शुष्क हाइड्रोक्लोरिक गैस शुष्क लिटमस पत्र के रंग को क्यों नहीं बदलती है?
अम्ल जलीय विलयन में विघटित होकर हाइड्रोजन आयन (H⁺) उत्पन्न करते हैं जो उनकी अम्लीयता के अभिलक्षण को प्रदर्शित करते हैं। शुष्क हाइड्रोक्लोरिक गैस और शुष्क लिटमस पत्र दोनों में ही जल का आभाव होने के कारण हाइड्रोजन आयन उत्पन्न नहीं हो पाते हैं। इसलिए शुष्क हाइड्रोक्लोरिक गैस शुष्क लिटमस पत्र के रंग को नहीं बदलती है।
अम्ल को तनुकृत करते समय यह क्यों अनुशंसित करते हैं कि अम्ल को जल में मिलाना चाहिए न की जल को अम्ल में?
जल में अम्ल के घुलने की प्रक्रिया अत्यंत उष्माक्षेपी होती है। सांद्र अम्ल में जल मिलाने पर उत्पन्न हुई ऊष्मा के कारण मिश्रण आस्फालित होकर बाहर आ सकता है तथा कोई भी जल सकता है। साथ ही अत्यधिक स्थानीय ताप के कारण प्रयोग में उपयोग किया जा रहा काँच का पात्र भी टूट सकता है। इसलिए अम्ल को सदैव धीरे – धीरे तथा जल को लगातार हिलाते हुए जल में मिलाना चाहिए।
पीतल एवं ताँबे के बर्तनों में दही एवं खट्टे पदार्थ क्यों नहीं रखने चाहिए?
दही और अन्य खट्टे पदार्थों में अम्ल होता है। इसलिए, जब उन्हें पीतल एवं ताँबे के बर्तनों में रखा जाता है, तो अम्ल धातु से क्रिया करके हानिकारक उत्पाद (लवण) बनाता है, जिससे भोजन खराब हो जाता है और खाने योग्य नहीं रहता है।
चींटी के दंश में उपस्थित अम्ल का नाम
चींटी के दंश में उपस्थित अम्ल मेथेनोइक अम्ल (फॉर्मिक अम्ल) है।
इसका रासायनिक सूत्र HCOOH है।
इससे राहत पाने के लिए कोई भी उपलब्ध क्षारीय लवण उदाहरणार्थ, बेकिंग सोडा (NaHCO₃) इस पर प्रयोग में लाया जा सकता है।
कक्षा 10 विज्ञान अध्याय 2 के अतिरिक्त प्रश्न उत्तर
क्या होता है जब अण्ड कवच में नाइट्रिक अम्ल मिलाया जाता है?
अण्ड कवच में कैल्सियम काबार्नेटे होता है। जब इसमें नाइटिक्र अम्ल मिलाया जाता है तो कार्बन डाइऑक्साइड गैस मुक्त होती है।
प्रबल एवं दुर्बल अम्ल क्या हैं? अम्लों की निम्नलिखित सूची से प्रबल अम्लों को दुर्बल अम्लों से पृथक कीजिए। हाइड्रोक्लोरिक अम्ल, साइट्रिक अम्ल, ऐसीटिक अम्ल, नाइट्रिक अम्ल, फार्मिक अम्ल, सल्फ्यूरिक अम्ल।
जलीय विलयनों में प्रबल अम्ल पूर्णतया आयनित होकर हाइड्रोनियम आयन देते हैं। वहीं दूसरी ओर दुर्बल अम्ल आंशिक आयनित होते हैं तथा समान मोलर सान्द्रता का जलीय विलयन अपेक्षाकृत बहुत कम H₃O⁺ सान्द्रता उपलब्ध कराता है।
- प्रबल अम्ल हाइड्रोक्लोरिक अम्ल, सल्फ्यूरिक अम्ल, नाइट्रिक अम्ल
- दुर्बल अम्ल सिट्रिक अम्ल, ऐसीटिक अम्ल, फॉर्मिक अम्ल
जब जिंक धातु की क्रिया एक प्रबल अम्ल के तनु विलयन से करायी जाती है तो एक गैस मुक्त होती है जो कि तेलों के हाइड्रोजनीकरण में उपयोग में आती है। मुक्त गैस का नाम दीजिए तथा बनने वाली गैस की पहचान के लिए परीक्षण लिखिए।
जब जिंक धातु प्रबल अम्लों के तनु विलयनों के साथ अभिक्रिया करता है तो यह लवण बनाता है तथा हाइड्रोजन गैस मुक्त होती है।
Zn + 2HCl → ZnCl₂ + H₂
जब जलती हुई तीली को परखनली के मुँह के पास ले जाया जाता है तो गैस पॉप ध्वनि के साथ जलती है।
कक्षा 10 विज्ञान अध्याय 2 को पढ़ने का आसान तरीका क्या है?
दसवीं कक्षा विज्ञान के अध्याय 2 को सरलता के साथ समझने का सबसे आसान तरीका यह है कि हम इस अध्याय में पढ़ी जाने वाली विभिन्न रासायनिक अभिक्रिया, चाहे वह अम्ल के साथ हो अथवा क्षार के साथ, का उदाहरण अपने दैनिक जीवन से समझने का प्रयास करें।
कक्षा 10 विज्ञान पाठ 2 के प्रारंभ में ही कुछ बातों का जिक्र होता है जिसमें हमें यह बताया जाता है कि हमारे भोजन में अलग अलग स्वाद का होना जैसे खट्टा या कड़वा, यह सब अम्ल और क्षारक की वजह से ही होता है।
यह बात हमारे मन में कई जिज्ञासाओं को जन्म देती है जिसका निराकरण इस अध्याय में होता है।
हर विषय को पढ़ते समय एक प्रश्न की तरह देखना चाहिए। जब भी आप अम्ल की धातुओं के साथ क्रियाओं का अध्ययन करें तब आपके मन में यह प्रश्न उठना चाहिए कि जब क्षारक धातुओं के साथ क्रिया करेगा तब भी क्या यही परिणाम प्राप्त होंगे अथवा इससे भिन्न होंगे। इसके अलावा कक्षा 10 के अभ्यास 2 का वीडियो अवश्य देखें। ताकि सब कुछ आपको विजुलाइजेशन के साथ समझ में आ सके। साथ ही स्वाध्ययन और समय-समय पर रिवीजन कारगर तरीका है, अध्याय को सरलता से समझने का याद करने का।
कक्षा 10 विज्ञान के अध्याय 2 में अधिकतम अंक कौसे प्राप्त करें?
सामान्य तौर पर कक्षा 10 विज्ञान के किसी भी अध्याय के अध्ययन में या अध्याय को परीक्षा के लिए तैयार करते समय आप मानसिक रूप से अपना जितना प्रतिशत देंगे उतना ही प्रतिशत परिणाम आप अपने लिए तैयार करते हैं। उदाहरण के लिए कक्षा 10 विज्ञान अध्याय 2 को पढ़ते समय यदि आप का ध्यान 90% इस अध्याय में है और 10% कहीं और तब इस बात की पूरी संभावना है कि आप का परिणाम 90% से अधिक नहीं आ सकता। इसीलिए सबसे जरूरी बात यह है कि आप जब कक्षा 10 विज्ञान के किसी भी अध्याय को तैयार करें तो अपना शत-प्रतिशत देने का प्रयास करें। इसके साथ ही 10वीं विज्ञान के अध्याय 2 को प्रारंभ से ही बड़ी गंभीरता के साथ समझने का प्रयास करें। दैनिक जीवन में किए जाने वाले कार्य को ध्यान में लाकर उन उदाहरणों को किसी न किसी अध्याय से जोड़ने का प्रयास करें। अलग-अलग समय पर अम्ल एवं छार के विषय में पढ़ते समय आप अपने निजी जीवन में हो रहे उनके उपयोग की कल्पना कर सकते हैं जिससे यह अध्याय आपको समझने में सफलता प्राप्त होगी। इसके अलावा जिन विषयों पर आप की पकड़ मजबूत नहीं है उन्हें आपको ज्यादा समय देने की जरूरत है। समय-समय पर रिवीजन निसंदेह अच्छा परिणाम लेकर आता है। इसके अलावा आप हमारी साइट पर उपलब्ध वीडियो या पीडीएफ़ भी देख सकते हैं जिससे आपको शत-प्रतिशत परिणाम प्राप्त करने में सहायता मिलेगी।
कक्षा 10 विज्ञान के अध्याय 2 में महत्वपूर्ण प्रश्नों को परीक्षा के लिए किस प्रकार तैयार करें?
10वीं कक्षा विज्ञान के अध्याय 2 में अम्ल की विभिन्न धातुओं के साथ की जाने वाली क्रियाएं, उन्हीं क्रियाओं के रासायनिक समीकरण साथ ही इन रासायनिक अभिक्रिया से प्राप्त विलियन के रासायनिक नाम याद होने चाहिए। इसके अलावा क्षार की विभिन्न धातुओं के साथ की जाने वाली अभिक्रियाएं, उनके रासायनिक समीकरण और उनसे प्राप्त विलियनों के नाम भी अच्छी तरह से समझकर याद करने चाहिए। अम्ल और छार के रासायनिक गुणधर्मों को समझना, वह भी विस्तार से। सभी प्रकार के अम्ल एवं क्षारकों में समानताएं, और पीएच मान एवं पीएच मान का दैनिक जीवन में महत्व आदि प्रश्न परीक्षा के दृष्टिकोण से कक्षा दसवीं के विज्ञान के अध्याय 2 में अत्यंत महत्वपूर्ण माने गए हैं। परीक्षा में आने वाले विभिन्न प्रकार के प्रश्न इन्हीं विषयों से पूछे जाने की अधिक संभावनाएं होती है।
अतः पूरा अध्याय पढ़ते समय यदि आप इन विषयों पर ध्यान देंगे तो आपके सभी प्रश्नों के उत्तर देने की संभावनाएं बढ़ जाएंगी।
कक्षा 10 विज्ञान के अध्याय 2 में किन प्रश्नों में अधिक कठिनाई होती है?
कक्षा 10 विज्ञान के अध्याय 2 में अम्ल एवं क्षार के रासायनिक गुण धर्मों को समझना और इसके साथ ही अम्ल एवं क्षार की भिन्न भिन्न धातुओं के साथ क्रियाएं, धातु कार्बोनेट तथा धातु हाइड्रोजन कार्बोनेट के साथ आपस में क्रियाएं, संबंधित प्रश्नों में रिवीजन की कमी से विद्यार्थी को कठिनाई महसूस हो सकती है।
किंतु सभी पहलुओं पर विस्तार से किया गया अध्ययन और समय-समय पर की गाई पुनरावृत्ति इन सभी कठिनाइयों को समाप्त कर देगा। इसके लिए आप तिवारी अकादमी वेबसाइट पर उपलब्ध वीडियो की मदद भी ले सकते हैं जिससे यह अध्याय आपको विस्तृत रूप से समझने में आसानी तो होगी साथ ही आप बड़ी ही सरलता के साथ में सभी प्रश्नों के उत्तर देने में खुद को सक्षम कर लेंगे।