कक्षा 9 विज्ञान अध्याय 4 एनसीईआरटी समाधान – परमाणु की संरचना
कक्षा 9 विज्ञान अध्याय 4 एनसीईआरटी समाधान पाठ 4 परमाणु की संरचना अभ्यास के प्रश्न उत्तर तथा पाठ के अंतर्गत सभी छोटे बड़े प्रश्नों के जवाब सीबीएसई सत्र 2025-26 के लिए विद्यार्थी यहाँ से प्राप्त कर सकते हैं। राजकीय बोर्डों के विद्यार्थी जैसे यूपी बोर्ड, एमपी बोर्ड, बिहार तथा उत्तराखंड बोर्ड आदि भी कक्षा 9 विज्ञान के दिए गए समाधान की मदद से अपने प्रश्नों के जवाब पा सकते हैं। मोबाइल से पढ़ने वाले विद्यार्थी कक्षा 9 विज्ञान ऐप की मदद ले सकते हैं। एक बार डाउनलोड करने के बाद इसे प्रयोग करने के लिए इंटरनेट की आवश्यकता नहीं पड़ती है।
कक्षा 9 विज्ञान अध्याय 4 के लिए एनसीईआरटी समाधान
कक्षा 9 विज्ञान अध्याय 4 के लिए एनसीईआरटी समाधान नीचे दिए गए हैं:
कक्षा 9 विज्ञान अध्याय 4 के बहुविकल्पीय प्रश्न (MCQ) उत्तर
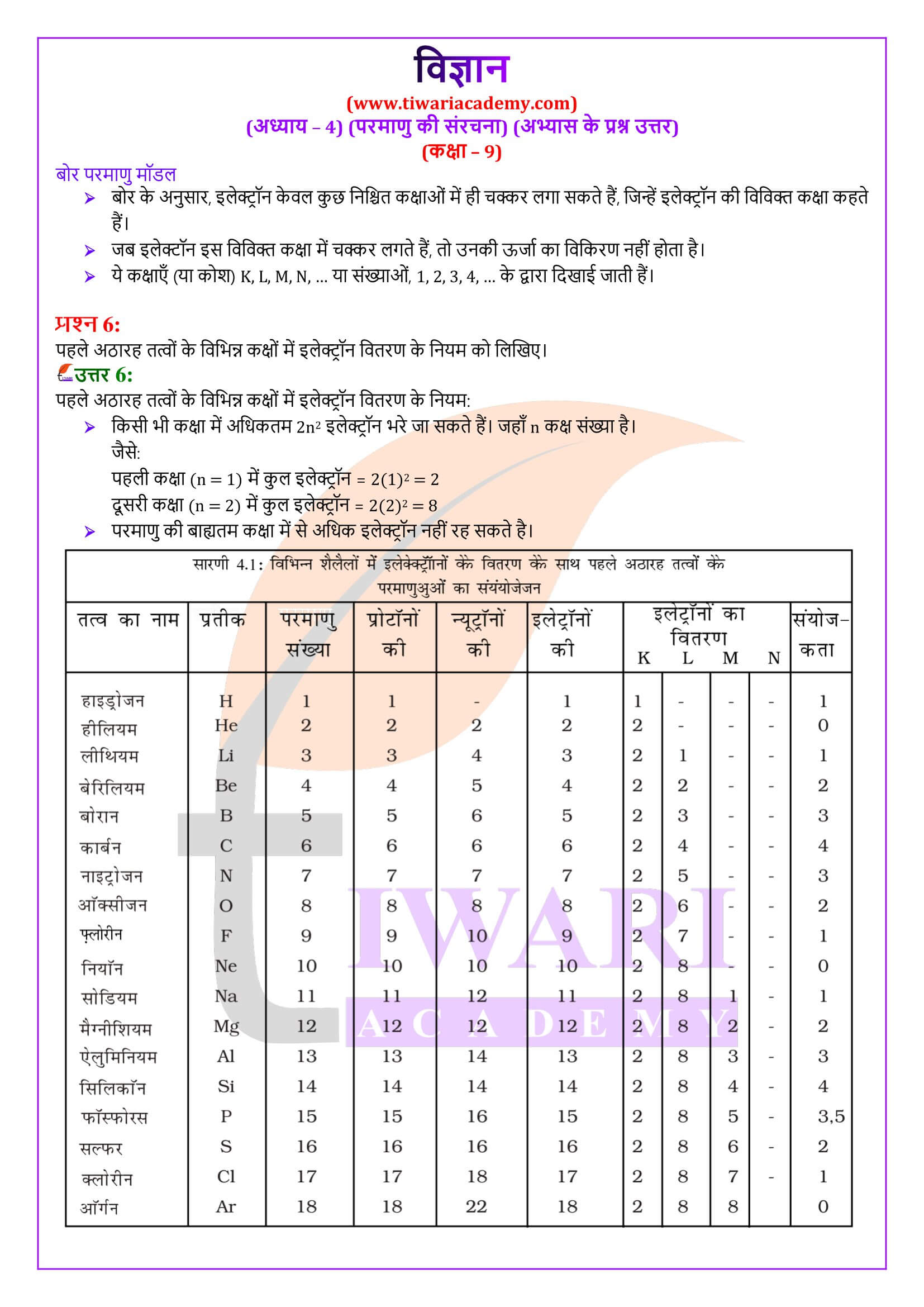
निम्नलिखित में से कौन-सा Mg परमाणु में इलेक्ट्रॉनिक वितरण को सही प्रदर्शित करता है?
रदरफोर्ड के ऐल्फा (α) कण प्रकीर्णन प्रयोग के परिणामस्वरूप खोज किया गया:
एक तत्व के लिए निम्नलिखित में से कौन-से विकल्प सही हैं? (i) परमाणु संख्या = प्रोटॉनों की संख्या + इलेक्ट्रॉनों की संख्या (ii) द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या (iii) परमाणु द्रव्यमान = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या (iv) परमाणु संख्या = प्रोटॉनों की संख्या + इलेक्ट्रॉनों की संख्या
एक तत्व के आयन पर 3 धन आवेश हैं। परमाणु की द्रव्यमान संख्या 27 और न्यूट्रॉनों की संख्या 14 है। आयन में कितने इलेक्ट्रॉन उपस्थित हैं?
1 संयोजकता वाले तत्व होते हैं:
परमाणु की संरचना से आप क्या समझते हैं?
- परमाणु
किसी तत्व की सबसे छोटी इकाई, जो स्वतंत्र अवस्था में नहीं पायी जाती है को परमाणु कहते हैं। सभी पदार्थ परमाणुओं और अणुओं से बने हैं। परमाणु रासायनिक अभिक्रिया में भाग ले सकता है। - डाल्टन का परमाणु मॉडल
डाल्टन के परमाणु सिद्धांत के अनुसार, “प्रत्येक पदार्थ छोटे-छोटे कणों से मिलकर बना होता है जिन्हें परमाणु कहते हैं और परमाणु को किसी भी भौतिक या रासायनिक विधि से विभाजित नहीं किया जा सकता है।” - इलेक्ट्रान
इलेक्ट्रॉन एक उप-परमाणु कण है, जिसका विद्युत आवेश ऋणात्मक है। इलेक्ट्रॉन की खोज जे जे टॉमसन ने 1897 में की थी। इलेक्ट्रान का द्रव्यमान 9.10938356 × 10⁻³¹ kg होता है। - प्रोटोन
परमाणु का वह कण जो धन आवेशित है और परमाणु के नाभिक में स्थित होता है। इस पर इलेक्ट्रान के बराबर और विपरीत आवेश होता है। प्रोटॉन की खोज अर्नेस्ट रदरफोर्ड द्वारा 1920 में की गयी थी। इसका द्रव्यमान 1.6726 x 10⁻²⁷ kg होता है। - न्यूट्रॉन
न्यूट्रॉन परमाणु का वह अनिवार्य घटक है जो अनावेशित ओर द्रव्यमान में प्रोटॉन के बराबर होता है। ये हाइड्रोजन को छोड़कर अन्य सभी परमाणुओं के नाभिक में होते हैं। इसकी खोज 1932 में चैडविक ने की थी। न्यूट्रॉन का द्रव्यमान 1.67493 × 10⁻²⁷ kg होता है, जो कि इलेक्ट्रॉन के द्रव्यमान से 1,839 गुना ज्यादा है।
कक्षा 9 विज्ञान अध्याय 4 के अतिरिक्त प्रश्न उत्तर
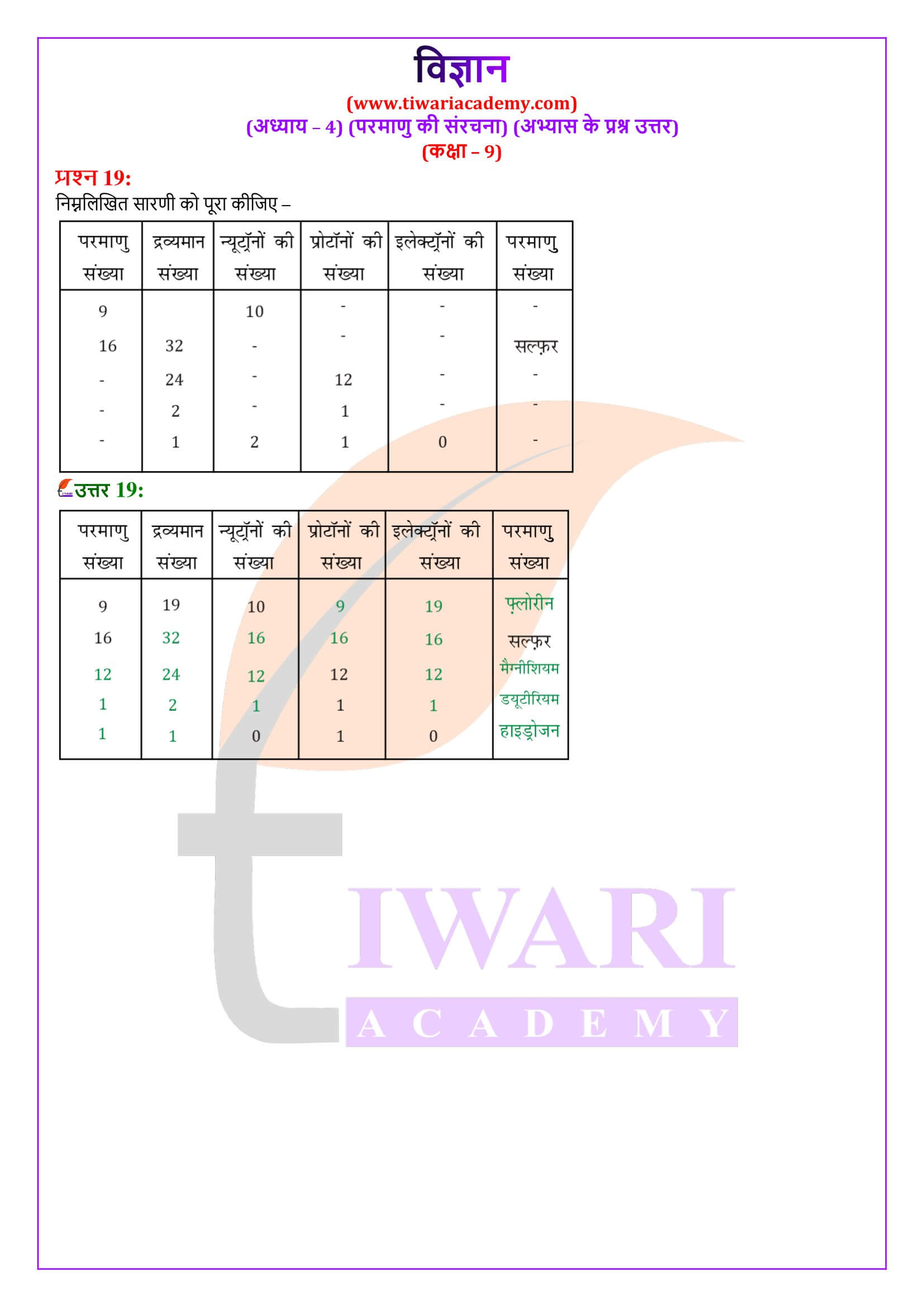
क्या यह संभव है कि किसी तत्व के एक परमाणु में एक इलेक्ट्रॉन, एक प्रोटॉन हो और कोई न्यूट्रॉन न हो। यदि ऐसा है, तो उस तत्व का नाम बताइए।
यह संभव है, हाइड्रोजन के नाभिक में 1 प्रोटॉन होता है तथा कक्षा में भी एक इलेक्ट्रॉन होता है। हाइड्रोजन में न्यूट्रॉन नहीं होता है।
क्लोरीन परमाणु के लिए इलेक्ट्रॉन वितरण लिखें। इसके L कोश में कितने इलेक्ट्रॉन होते हैं? (क्लोरीन का परमाणु क्रमांक 17 है)।
बोर-बरी योजना के अनुसार परमाणु की किसी भी कक्षा में इलेक्ट्रॉनों की संख्या 2n² होती है।
K (पहली कक्षा) में इलेक्ट्रॉनों की संख्या = 2 x 1² = 2
L (दूसरी कक्षा) में इलेक्ट्रॉनों की संख्या = 2 x 2² = 8
अतः कह सकते हैं कि क्लोरिन के L कोश में 8 इलेक्ट्रॉन होते हैं।
हीलियम के संयोजकता कोश में 2 इलेक्ट्रॉन हैं, परंतु इसकी संयोजकता 2 नहीं है। समझाइए।
हीलियम के बाह्यतम कोश में 2 इलेक्ट्रॉन होते हैं और इसका द्विक पूर्ण हो जाता है। अत: इसकी संयोजकता शून्य होती है।
बोर का परमाण्विक मॉडल क्या है?
बोर का परमाण्विक मॉडल
रदरफोर्ड के मॉडल पर उठी आपत्तियों को दूर करने के लिए, नील्स बोर ने परमाणु की संरचना के बारे में निम्नलिखित अवधारणाएँ प्रस्तुत की:
- इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं, जिन्हें इलेक्ट्रॅान की विविक्त कक्षा कहते हैं।
- जब इलेक्ट्रॅान इस विविक्त कक्षा में चक्कर लगाते हैं, तो उनकी उर्जा का विकिरण नहीं होता है। इन कक्षाओं को K, L, M, N द्वारा दिखाया जाता है।
कक्षा 9 विज्ञान अध्याय 4 अभ्यास के लिए प्रश्न उत्तर
हीलियम, निऑन और ऑर्गन की संयोजकता शून्य क्यों होती है?
हीलियम के एकमात्र संयोजकता कोश में दो इलेक्ट्रॉन हैं, जबकि आर्गन और निऑन के संयोजकता
कोशों में 8 इलेक्ट्रॉन हैं, क्योंकि इन तत्वों के संयोजकता कोशों में इलेक्ट्रॉनों की अधिकतम संख्या
उपस्थित है, इनमें अन्य तत्वों से संयोग करने की कोई प्रवृत्ति नहीं होती है। अत: इनकी संयोजकता
शून्य होती है।
रदफोर्ड के α-किरण प्रकीर्णन प्रयोग से निकाले गए निष्कर्षों की सूची बनाइए।
α-कण प्रकीर्णन प्रयोग से रदरफोर्ड ने निष्कर्ष निकाला कि:
(i) परमाणु में अधिकांश स्थान रिक्त है क्योंकि अधिकांश कण सोने की पन्नी में से बिना विक्षिप्त हुए निकल जाते हैं।
(ii) बहुत कम कण अपने मार्ग से विक्षेपित होते हैं, जिससे ज्ञात होता है कि परमाणु का धन आवेश बहुत कम स्थान में सीमित है।
(iii) α-कणों का एक बहुत छोटा अंश 180⁰ पर विक्षेपित हो जाता है जिससे ज्ञात होता है कि संपूर्ण धन आवेश और गोल्ड परमाणु का द्रव्यमान परमाणु में एक बहुत छोटे आयतन में केंद्रित है।
आंकड़ों से उन्होंने यह भी परिकलित किया कि नाभिक की त्रिज्या परमाणु की त्रिज्या से लगभग 105 गुना कम है।
बोर के परमाणु मॉडल के अभिगृहीत क्या हैं?
परमाणु के मॉडल से संबंधित नील्स बोर ने निम्नलिखित निष्कर्ष प्रस्तुत किए:
(i) केवल कुछ विशिष्ट कक्षाएँ, जो इलेक्ट्रॉनों की विविक्त कक्षाएँ कहलाती हैं, परमाणु में मान्य हैं।
(ii) विविक्त कक्षाओं में चक्कर लगाते हुए इलेक्ट्रॉन उर्जा का विकिरण नहीं करते।
इन कक्षाओं को उर्जा स्तर कहते हैं। परमाणु में उर्जा स्तरों को वृत्तों द्वारा दर्शाया जाता है।
ये कक्षाएँ अक्षरों K, L, M, N……….
या
संख्याओं n 1, 2, 3, 4,….. द्वारा प्रदर्शित की जाती हैं।
कक्षा 9 विज्ञान अध्याय 4 के नोट्स (मुख्य बिन्दु)
कक्षा 9 विज्ञान अध्याय 4 के महत्वपूर्ण तथ्य
- 1. इलेक्ट्रॉन और प्रोटॅान की खोज क्रमश: जे. जे. टॉमसन और ई. गोल्डस्टीन ने की।
- 2. जे. जे. टॉमसन ने यह प्रस्तावित किया था कि इलेक्ट्रॅान धनात्मक गोले में धँसे होते हैं।
- 3. रदरप़ोर्ड के अल्प़ा कणों के प्रकीर्णन प्रयोग ने परमाणु केंद्रक की खोज की।
- 4. रदरप़फोर्ड के परमाणु मॉडल ने प्रस्तावित किया कि परमाणु के अंदर बहुत छोटा केंद्रक होता है और इलेक्ट्रॅान केंद्रक के चारों ओर घूमते हैं। परमाणु की स्थिरता की इस मॉडल से व्याख्या नहीं की जा सकी है।
- 5. नील बोर द्वारा दिया गया परमाणु का मॉडल अधिक सफ्ल था। उन्होंने प्रस्तावित किया कि इलेक्ट्रॅान केंद्रक के चारों ओर निश्चित उर्जा के साथ अलग-अलग कक्षाओं में वितरित हैं। अगर परमाणु की सबसे बाहरी कक्षाएँ भर जाती हैं, तो परमाणु स्थिर होगा और कम क्रियाशील होगा।
- 6. जे. चैडविक ने परमाणु के अंदर न्यूट्रॅान की उपस्थिति को खोजा। इस प्रकार परमाणु के तीन अवपरमाणुक कण हैं: इलेक्ट्रॅान, प्रोटॉन और न्यूट्रॉन। इलेक्ट्रॅान ऋण आवेशित होते हैं, प्रोटॅान धनावेशित होते हैं और न्यूट्रॅान अनावेशित होते हैं। इलेक्ट्रॅान का द्रव्यमान हाइड्रोजन परमाणु के द्रव्यमान के 1/2000 गुणा होता है। प्रोटॉन और न्यूट्रॉन में प्रत्येक का द्रव्यमान एक इकाई लिया जाता है।
- 7. परमाणु के कक्षों को K, L, M, N, ……… नाम दिया गया है।
- 8. संयोजकता परमाणु की संयोजन शक्ति है।
- 9. एक तत्व की परमाणु संख्या केंद्रक में विद्यमान प्रोटॉनों की संख्या के बराबर होती है।
- 10. परमाणु की द्रव्यमान संख्या केंद्रक में विद्यमान न्यूक्लियानों की संख्या के बराबर होती है।
- 11. समस्थानिक एक ही तत्व के परमाणु हैं जिनकी द्रव्यमान संख्या भिन्न-भिन्न होती है।
- 12. समभारिक वे परमाणु हैं जिनकी द्रव्यमान संख्या समान लेकिन परमाणु संख्या भिन्न-भिन्न होती है।
- 13. तत्वों को उनके प्रोटॉनों की संख्या के आधार पर परिभाषित किया जा सकता है।
कक्षा 9 विज्ञान अध्याय 4 के महत्वपूर्ण प्रश्न उत्तर
केनाल किरणें क्या हैं?
केनाल किरणें धनावेशित विकिरण हैं जो प्रोटॉनों से मिलकर बनी होती हैं। इसकी खोज 1886 में ई. गोल्डस्टीन ने की थी।
यदि किसी परमाणु में एक इलेक्ट्रान और एक प्रोटॉन है, तो इसमें कोई आवेश होगा या नहीं?
प्रोटॉन पर जितना धनात्मक आवेश होता है इलेक्ट्रॉन पर उतना ही ऋणात्मक आवेश होता है। अतः यदि किसी परमाणु में एक इलेक्ट्रान और एक प्रोटॉन है, तो इसमें कोई आवेश नहीं होगा। परमाणु विधुत उदासीन होगा।
परमाणु उदासीन है, इस तथ्य को टॉमसन के मॉडल के आधार पर स्पष्ट कीजिए।
टॉमसन के मॉडल के आधार पर, परमाणु में ऋणात्मक और धनात्मक आवेश परिमाण में समान होते हैं। इसलिए परमाणु वैधुतीय रूप से उदासीन होते हैं।
रदरफ़ोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में कौन सा अवपरमाणुक कण विद्यमान है?
रदरफ़ोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में प्रोटॉन (धनात्मक आवेशित कण) विद्यमान है।
क्या अल्फ़ा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु की पन्नी से संभव होगा?
अल्फ़ा कणों का प्रकीर्णन सोने की पतली पन्नी के अलावा किसी अन्य धातु की पन्नी से संभव नहीं है। क्योंकि किसी अन्य धातु की 1000 परमाणु मोटी पन्नी बनाना संभव नहीं है।
अगर किसी परमाणु का K और L कोश भरा है, तो उस परमाणु में इलेक्ट्रॉनों की संख्या क्या होगी?
K कोश में इलेक्ट्रॉनों की कुल संख्या = 2 L कोश में इलेक्ट्रॉनों की कुल संख्या = 8 इसलिए, कुल इलेक्ट्रॉन = 2 + 8 = 10 अतः, उस परमाणु में इलेक्ट्रॉनों की संख्या 10 होगी।
यदि किसी परमाणु में इलेक्ट्रॉनों की संख्या 8 है और प्रोटॉनों की संख्या भी 8 है तब, (a) परमाणु की परमाणु संख्या क्या है? (b) परमाणु का क्या आवेश है?
(a) हम जानते हैं कि, परमाणु संख्या = प्रोटॉनों की संख्या अतः, परमाणु की परमाणु संख्या = 8 (b) परमाणु का आवेश = प्रोटॉनों की संख्या – इलेक्ट्रॉनों की संख्या = 8 – 8 = 0 अतः, परमाणु पर कोई आवेश नहीं है और परमाणु उदासीन है।