एनसीईआरटी समाधान कक्षा 12 रसायन अध्याय 5 उपसहसंयोजन यौगिक
एनसीईआरटी समाधान कक्षा 12 रसायन विज्ञान अध्याय 5 उपसहसंयोजन यौगिक हिंदी और अंग्रेजी मीडियम में सत्र 2025-26 के लिए यहाँ से निशुल्क प्राप्त करें। कक्षा 12 रसायन शास्त्र के पाठ 5 के अभ्यास तथा पाठ्यनिहित सभी प्रश्न उत्तर विस्तार से चित्रों और रासायनिक सूत्रों के माध्यम से समझाए गए हैं।
एनसीईआरटी समाधान कक्षा 12 रसायन विज्ञान अध्याय 5
कक्षा 12 रसायन विज्ञान अध्याय 5 उपसहसंयोजन यौगिक के प्रश्न उत्तर
उपसहसंयोजक यौगिक
संक्रमण धातुएं बड़ी संख्या में संकुल यौगिक बनाती हैं, जिनमें धातु परमाणु अनेक ऋणायनों अथवा उदासीन अणुओं से इलेक्ट्रॉनों का सहसंयोजन कर परिबद्ध रहते हैं। आधुनिक पारिभाषिक शब्दावली में ऐसे यौगिक उपसहसंयोजन यौगिक कहलाते हैं।
उदाहरण:
क्लोरोफिल, हीमोग्लोबिन तथा विटामिन B₁₂ क्रमशः मैग्नीशियम, आयरन तथा कोबाल्ट के उपसहसंयोजन यौगिक हैं।
उपसहसंयोजन यौगिक का वर्नर का सिद्धांत
वर्नर ने 1898 में उपसहसंयोजन यौगिकों का सिद्धांत प्रस्तुत किया। इस सिद्धांत की मुख्य अभिधारणाएं निम्नलिखित हैं:
- उपसहसंयोजन यौगिकों में धातुएं दो प्रकार की संयोजकताएं दर्शाती हैं- प्राथमिक तथा द्वितीयक।
- प्राथमिक संयोजकताएं सामान्य रूप से आयननीय होती हैं तथा ऋणात्मक आयनों द्वारा संतुष्ट होती हैं।
- द्वितीयक संयोजकताएं अन-आयननीय होती हैं। ये उदासीन अणुओं अथवा ऋणात्मक आयनों द्वारा संतुष्ट होती हैं। द्वितीयक संयोजकता उपसहसंयोजन संख्या के बराबर होती है तथा इसका मान किसी धातु के लिए सामान्यतः निश्चित होता है।
- धातु से द्वितीयक संयोजकता से आबंधित आयन समूह विभिन्न उपसहसंयोजन संख्या के अनुरूप दिक् स्थान में विशिष्ट रूप से व्यवस्थित रहते हैं।
कक्षा 12 रसायन विज्ञान अध्याय 5 एमसीक्यू
0.1 मोल CoCl₃(NH₃)₅ की AgNO₃ के आधिक्य से अभिक्रिया कराने पर AgCl के 0.2 मोल प्राप्त होते हैं। विलयन की चालकता ______ के समकक्ष होगी।
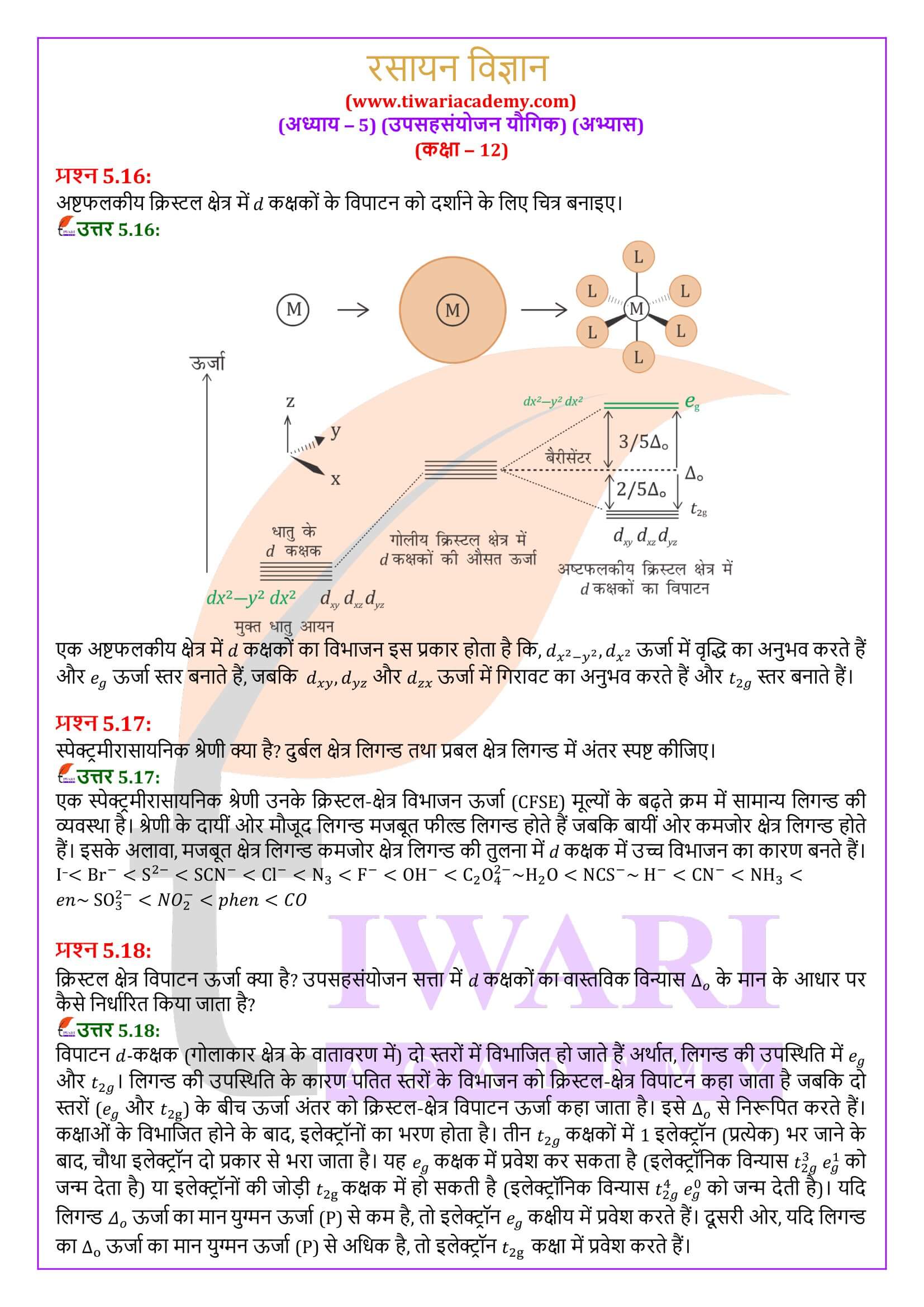
[Pt(NH₃)₂Cl₂], का आईयूपीएसी नाम है:
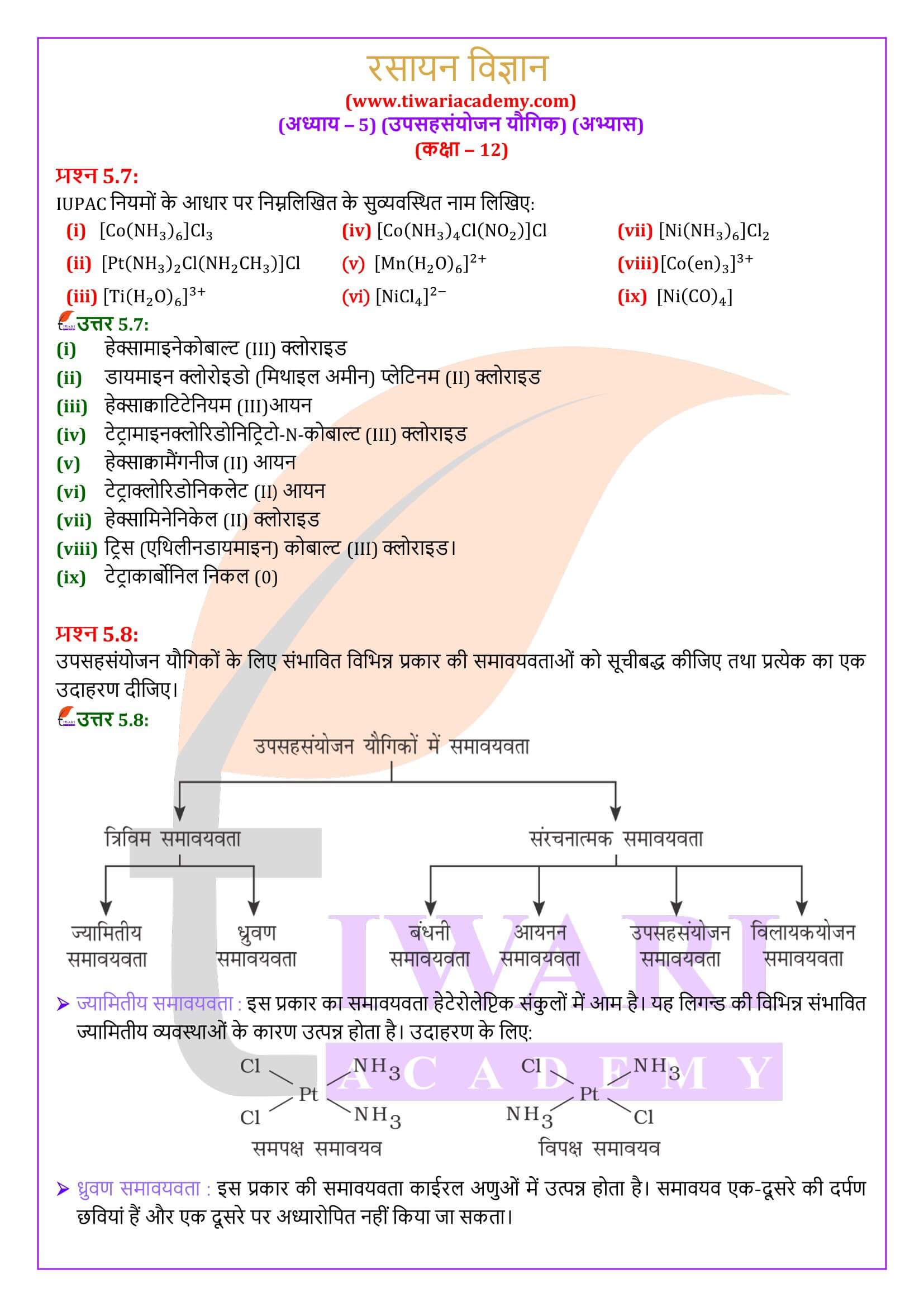
कीलेशन द्वारा उपसहसंयोजन यौगिकों का स्थायित्व कीलेट प्रभाव कहलाता है। निम्नलिखित में से कौन-सी संकुल स्पीशीज सर्वाधिक स्थायी है?
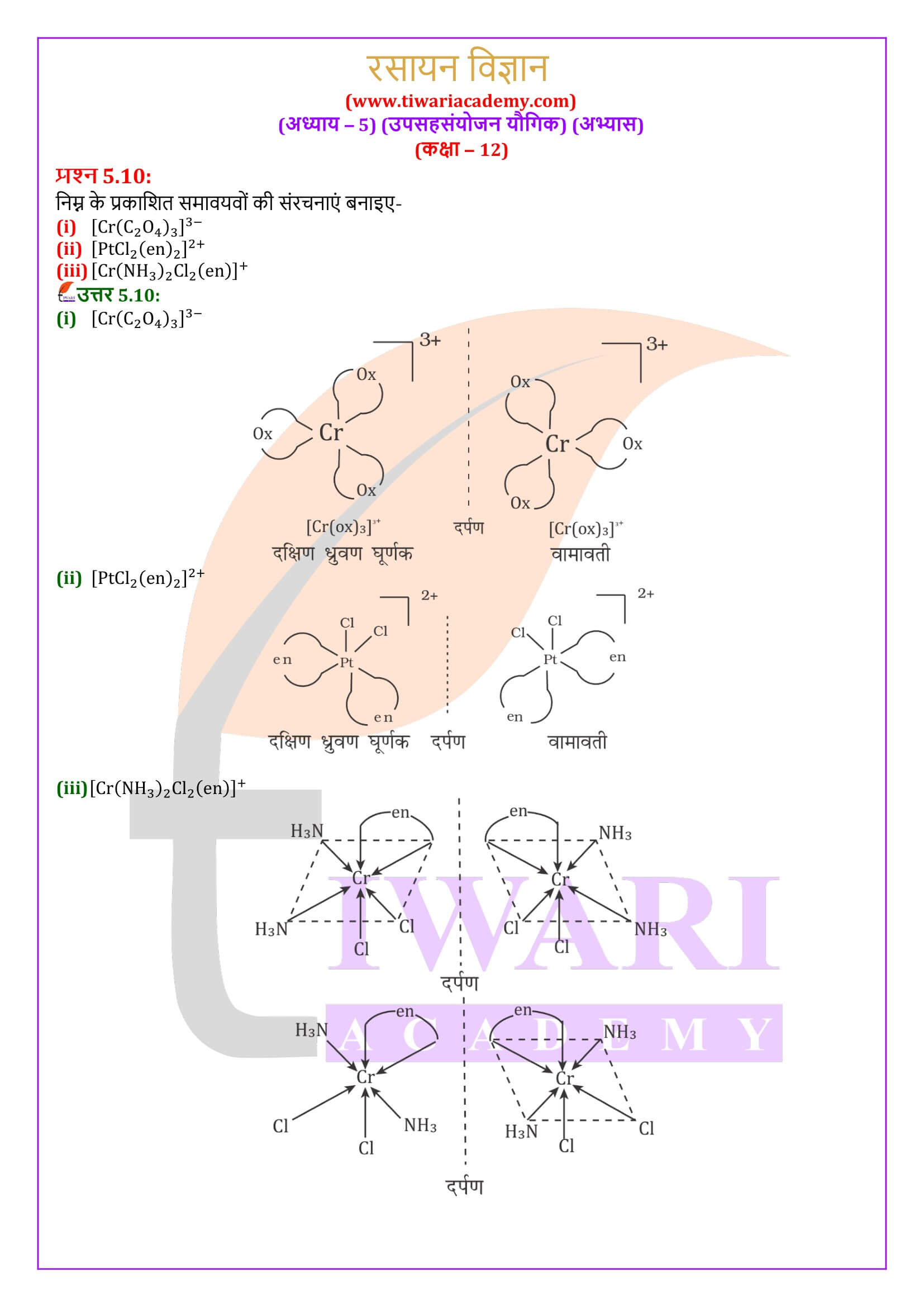
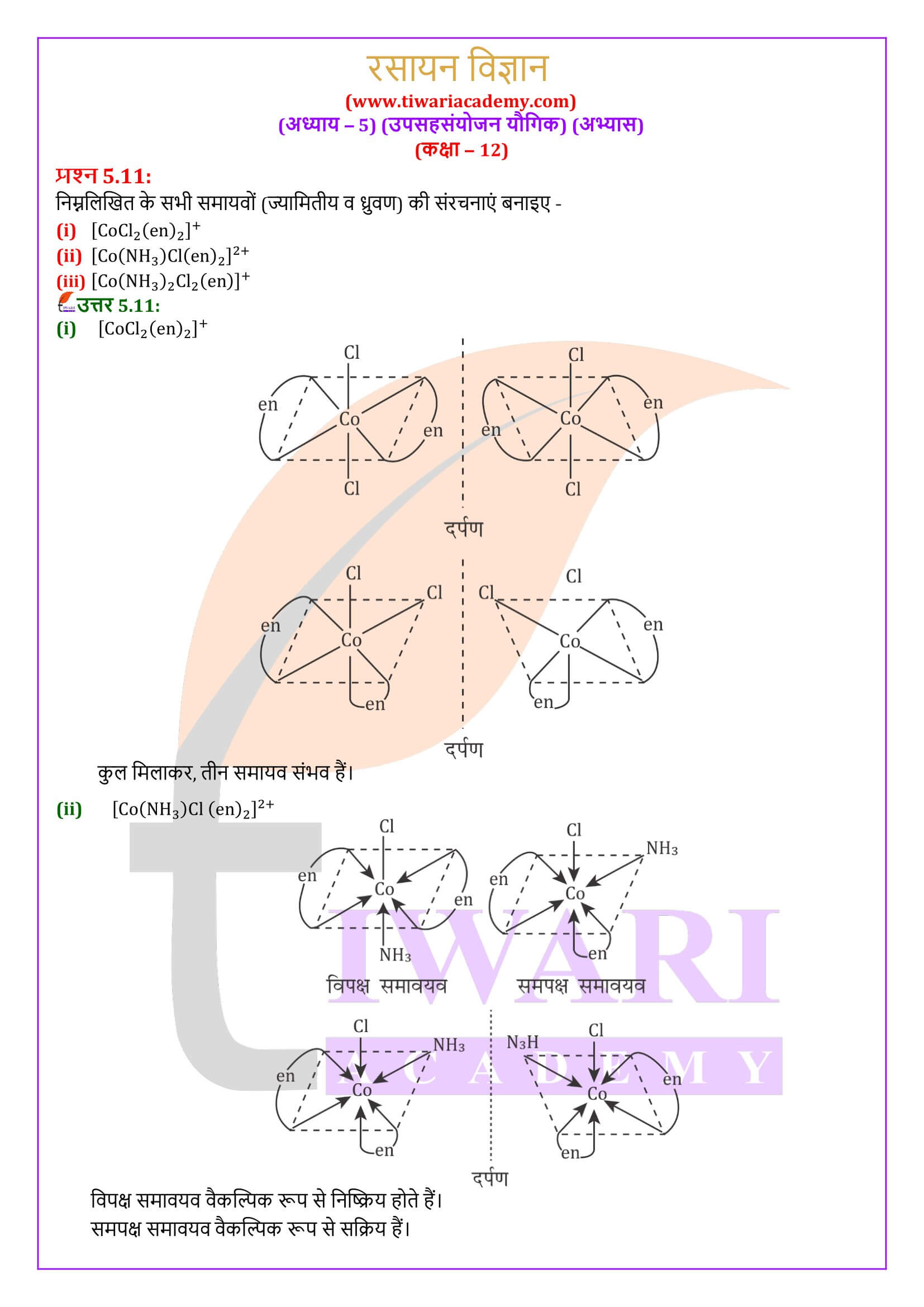
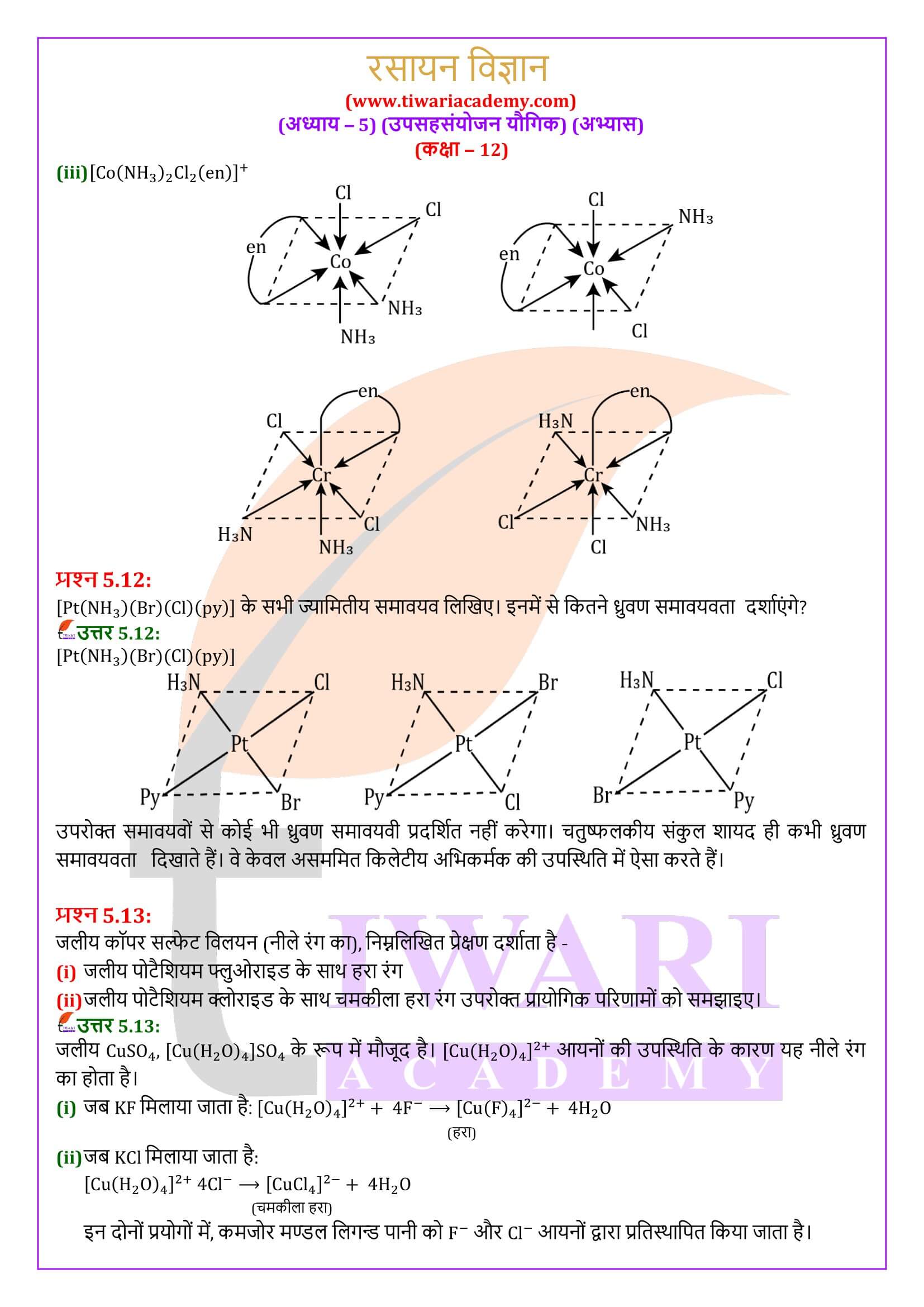
वह संकुल आयन इंगित कीजिए जो ज्यामितीय समावयवता प्रदर्शित करता है।
उपसहसंयोजन सत्ता या समन्वय सत्ता
केंद्रीय धातु परमाणु अथवा आयन से किसी एक निश्चित संख्या में आबंधित आयन अथवा अणु मिलकर एक उपसहसंयोजन सत्ता का निर्माण करते हैं। उदाहरणार्थ, [CoCl₃(NH₃)₃], एक उपसहसंयोजन सत्ता है जिसमें कोबाल्ट आयन तीन अमोनिया अणुओं तथा तीन क्लोराइड आयनों से घिरा है। अन्य उदाहरण हैं, [Ni(CO)₄], [PtCl₂(NH₃)₂], [Fe(CN)₆]⁴⁻, [Co(NH₃)₆]³⁺ आदि।
केंद्रीय परमाणु/आयन
किसी उपसहसंयोजन सत्ता में, परमाणु/आयन जो एक निश्चित संख्या में अन्य आयनों/ समूहों से एक निश्चित ज्यामिती व्यवस्था में परिबद्ध रहता है, केंद्रीय परमाणु अथवा आयन कहलाता है। उदाहरणार्थ, [NiCl₂(H₂O)₄], [CoCl(NH₃)₅]²⁺, तथा [Fe(CN)₆]³⁻ में केन्द्रीय परमाणु/ आयन क्रमशः Ni²⁺, Co³⁺ तथा Fe³⁺ हैं। इन केंद्रीय परमाणुओं/आयनों को लूइस अम्ल भी कहा जाता है।
कक्षा 12 रसायन विज्ञान अध्याय 5 बहुविकल्पीय प्रश्न उत्तर
अष्टफलकीय [CoCl₆]4⁻ के लिए CFSE 18,000 cm⁻¹ है, तो चतुष्फलकीय [CoCl₄]2⁻ की CFSE होगी :
उभयदंती लिगंड के कारण उपसहसंयोजन यौगिक समावयवता दर्शाते हैं। पैलेडियम के [Pd(C₆H₅)₂(SCN)₂], और [Pd(C₆H₅)₂(NCS)₂], संकुल हैं:
यौगिक [Co(SO₄)(NH₅)₅]Br और [Co(SO₄)(NH₃)₅]Cl ________ प्रदर्शित करते हैं।
कीलेटी कर्मक में एक धातु आयन से आबंधन के लिए दो अथवा दो से अधिक दाता परमाणु होते हैं। निम्नलिखित में से कौन-सा कीलेटी कर्मक नहीं है?
लिगन्ड
उपसहसंयोजन सत्ता में केंद्रीय परमाणु/आयन से परिबद्ध आयन अथवा अणु लिगन्ड कहलाते हैं। ये सामान्य आयन हो सकते हैं जैसे Cl⁻, छोटे अणु हो सकते हैं जैसे H₂O या NH₃ बड़े अणु हो सकते हैं जैसे: H₂NCH₂CH₂NH₂; या N(CH₂CH₂NH₂)₃ अथवा बृहदणु भी हो सकते हैं जैसे प्रोटीन।
जब एक लिगन्ड, धातु आयन से एक दाता परमाणु द्वारा परिबद्ध होता है, जैसे Cl⁻, H₂O या NH₃ तो लिगन्ड एकदंतुर कहलाता है। जब लिगन्ड दो दाता परमाणुओं द्वारा परिबद्ध हो सकता है, जैसे H₂NCH₂CH₂NH₂ (एथेन-1, 2-डाइऐमीन) अथवा C₂O₄ (ऑक्सैलेट), तो ऐसा लिगन्ड द्विदंतुर और जब एक लिगन्ड में अनेक दाता परमाणु उपस्थित हों, जैसा कि N(CH₂CH₂NH₂)₃ में हैं, तो लिगन्ड बहुदंतुर कहलाता है। एथिलीनडाइऐमीनटेट्रा एसीटेट आयन एक महत्वपूर्ण षट्दंतुर लिगन्ड है। यह दो इट्रोजन तथा चार ऑक्सीजन परमाणुओं द्वारा एक केंद्रीय धातु आयन से जुड़ सकता है।
कक्षा 12 रसायन विज्ञान अध्याय 5 के महत्वपूर्ण प्रश्न उत्तर
[MnCl₄]²⁻ का चुंबकीय आघूर्ण 5.92 BM है। इसे कारण सहित स्पष्ट कीजिए।
मान लीजिए चुंबकीय आघूर्ण का 5.92 BM Mn²⁺ के d-कक्षकों के पाँच अयुगलित इलेक्ट्रॉनों के अनुरूप है। परिणामस्वरूप निहित संकरण dsp² के बजाय sp³ होता है। अतः [MnCl₄]²⁻ की चतुष्फलकीय संरचना के चुंबकीय आघूर्ण का मान 5.92 BM होता है।
[Fe(H2O)6]³⁺ का चुंबकीय आघूर्ण 5.92 BM होता है जबकि [Fe(CN)6]³⁻ का चुंबकीय आघूर्ण केवल 1.74 BM होता है। स्पष्ट कीजिए।
[Fe(CN)6]³⁻ में d²sp³ संकरण होता है और एक अयुगलित इलेक्ट्रॉन होता है परन्तु [Fe(H2O)6]³⁺ में sp³d² संकरण होता है तथा 5 अयुगलित इलेक्ट्रॉन होते हैं। यह अन्तर इन संकुलों में क्रमशः प्रबल CN⁻ और दुर्बल H₂O लिगंडों के कारण होता है।
CuSO₄.5H₂O का रंग नीला होता है जबकि CuSO₄ रंगहीन होता है क्यों?
CuSO₄.5H₂O में जल लिगंड की तरह कार्य करता है। अतः यह क्रिस्टल क्षेत्र विपाटन करता है इसलिए CuSO₄.5H₂O में d-d स्थानांतरण संभव है और इसीलिए यह रंग प्रदर्शित करता है। परन्तु निर्जल CuSO₄ में लिगंड (जल) की अनुपस्थिति में क्रिस्टल क्षेत्र विपाटन संभव नहीं होगा अतः रंग भी नहीं होगा।
उपसहसंयोजन संख्या
एक संकुल में धातु आयन की उपसहसंयोजन संख्या उससे आबंधित लिगन्डों के उन दाता परमाणुओं की संख्या के बराबर होती है, जो सीधे धातु आयन से जुड़े हों।
उदाहरणार्थ, संकुल आयनों, [PtCl₆]²⁻, तथा [Ni(NH₃)₄]²⁺ में Pt तथा Ni की उपसहसंयोजन संख्या क्रमशः 6 तथा 4 हैं।
एनसीईआरटी कक्षा 12 रसायन शास्त्र अध्याय 5 उपसहसंयोजन यौगिक के मुख्य विषय कौन से हैं?
रसायन विज्ञान एनसीईआरटी कक्षा 12 पाठ 5 उपसहसंयोजन यौगिक एक रोचक एवं महत्वपूर्ण अध्याय है। इस अध्याय के माध्यम से, छात्रों को उपसहसंयोजन बंध, समावयवता, उनके अनुप्रयोगों तथा स्थिरता आदि कई अन्य महत्वपूर्ण पहलुओं सहित उपसहसंयोजन यौगिकों के बारे में विस्तार से समझाया गया है। कक्षा 12 रसायन शास्त्र के पाठ 5 के मुख्य विषय उपसहसंयोजन यौगिकों का नामकरण, यौगिकों में संबंध, बंधनों पर आधारित विभिन्न सिद्धांत, यौगिकों का समरूपता, धातु कार्बोनिल्स में संबंध, यौगिकों का महत्व, अनुप्रयोग और उनकी स्थिरता के बारे में विस्तार से अध्ययन करते हैं।
कक्षा 12 रसायन शास्त्र में अध्याय 5 का क्या महत्व है?
उपसहसंयोजन यौगिकों पर आधारित अध्याय 5 कक्षा 12 रसायन शास्त्र के अकार्बनिक भाग में एक महत्वपूर्ण विषय है। उपसहसंयोजन यौगिक डी और एफ ब्लॉक तत्वों के साथ मिलकर परीक्षा के लिए और भी अधिक महत्वपूर्ण बन जाते हैं। कक्षा 12 रसायन शास्त्र के अकार्बनिक भाग में से लगभग 12 अंकों के प्रश्न परीक्षा में पूंछे जाते हैं। एनसीईआरटी कक्षा 12 रसायन विज्ञान पाठ 5 समाधान रासायनिक बंधों को बेहतर ढंग से समझने और संशोधित करने में मदद करेगा। बेहतर तैयारी के लिए छात्र उपसहसंयोजन यौगीक कक्षा 12 एनसीईआरटी समाधान मेनन सभी प्रश्नों का विस्तृत हल दिया गया है ताकि विद्यार्थी कक्षा 12 की परीक्षा में बेहतर प्रदर्शन के लिए खुद को तैयार कर सकें।
कक्षा 12 रसायन शास्त्र अध्याय 5 के प्रश्नों को आसानी से कैसे हल करें?
रसायन विज्ञान अध्याय 5 उपसहसंयोजन यौगिक मुख्य रूप से यौगिकों के रासायनिक सूत्रों के नामकरण से संबंधित प्रश्नों से भरा है। इसमें विभिन्न यौगिकों के कक्षकों का मानचित्रण भी आवश्यक है। इस अध्याय में छात्रों से यह भी अक्सर पूँछा जाता है कि कुछ यौगिकों के कुछ विशेष रंग ही क्यों होते हैं। यहाँ उपसहसंयोजन यौगिकों के परिक्षण तथा उनकी पहचान पर आधारित प्रश्न भी दिए गए हैं। यदि विद्यार्थी इन सवालों के जवाब की तलाश में हैं, तो एनसीईआरटी से उपसहसंयोजन यौगिक समाधान यहाँ से निशुल्क प्राप्त करने और अपनी परीक्षा की तैयारी में इससे मदद लें। इससे आपको एनसीईआरटी के अभ्यास तथा पाठ्यनिहित प्रश्नों के सटीक हल और उत्तर लिखने में मदद मिलेगी। इसके अतिरिक्त, जो छात्र प्रश्नों को स्वयं हल करने में सक्षम हैं, उन्हें अपने उत्तर को सत्यापित करने के लिए मदद मिलेगी।