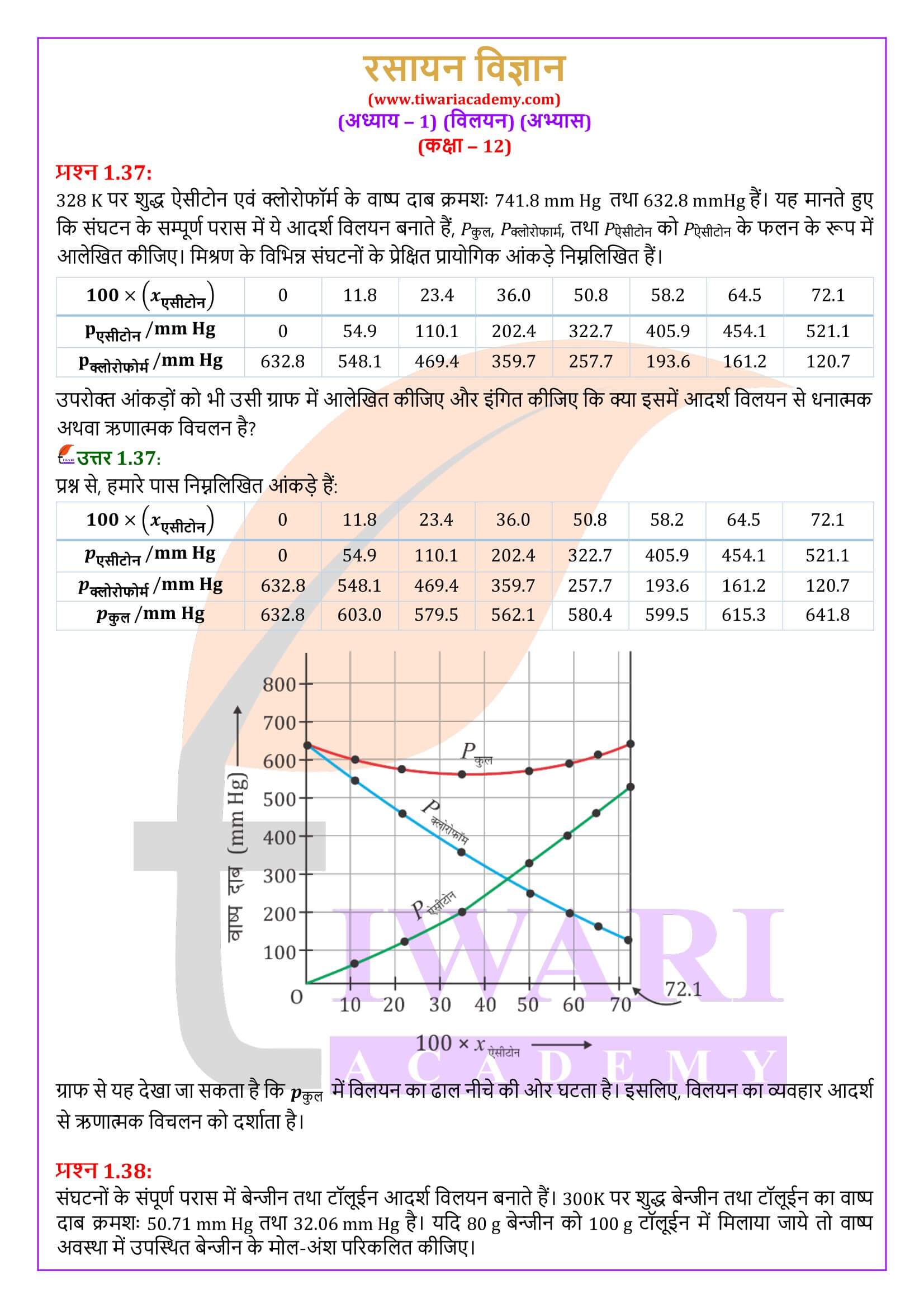
एनसीईआरटी समाधान कक्षा 12 रसायन अध्याय 1 विलयन
एनसीईआरटी समाधान कक्षा 12 रसायन विज्ञान अध्याय 1 विलयन के सवाल जवाब हिंदी और अंग्रेजी मीडियम में सत्र 2025-26 के लिए यहाँ से डाउनलोड किए जा सकते हैं। 12वीं कक्षा के रसायन शास्त्र पाठ 1 के पाठ्यनिहित प्रश्नों के साथ-साथ विद्यार्थी यहाँ से अभ्यास के प्रश्नों के उत्तर भी चरण दर चरण समझ सकते हैं।
एनसीईआरटी समाधान कक्षा 12 रसायन अध्याय 1
कक्षा 12 रसायन विज्ञान अध्याय 1 विलयन के प्रश्न उत्तर
विलयन, विलायक और विलेय
विलयन
दो या दो से अधिक अवयवों के समांगी मिश्रण को विलयन कहा जाता है। समांगी मिश्रण से हमारा तात्पर्य है कि मिश्रण में सभी जगह इसका संघटन व गुण एक समान होते हैं। जैसे नमक तथा जल का मिश्रण, ऑक्सीजन तथा नाइट्रोजन का मिश्रण, चीनी तथा जल का मिश्रण आदि।
विलायक
सामान्यतः जो अवयव अधिक मात्र में उपस्थित होता है, वह विलायक कहलाता है। विलायक विलयन की भौतिक अवस्था निर्धारित करता है, जिसमें विलयन विद्यमान होता है। जैसे नमक तथा जल के मिश्रण में जल विलायक है।
विलेय
किसी समांगी विलयन में जो पदार्थ कम मात्रा में होता है उसे विलेय कहते है। अर्थात कोई भी विलयन विलायक और विलेय दोनों से मिलकर बना होता है। उदहारण नमक तथा जल के मिश्रण में नमक विलेय है।
कक्षा 12 रसायन विज्ञान अध्याय 1 बहुविकल्पीय प्रश्न उत्तर
निम्नलिखित में से कौन-सी इकाई विलयन की सांद्रता का वाष्प दाब से संबंध बताने के लिए उपयोगी है?
कक्ष ताप पर शर्करा को जल में घोलने पर विलयन छूने से ठंडा लगता है? निम्नलिखित में से किस स्थिति में शर्करा की विलीनता सर्वाधिक तेजी से होगी?
हाइड्रोजन आबंधन का बनना, टूटना और मजबूती को दृष्टिगत रखते हुए अनुमान लगाइए कि निम्नलिखित मिश्रणों में से कौन-सा राउल्ट के नियम से धनात्मक विचलन दर्शाएगा?
अणुसंख्य गुणधर्म ________ पर निर्भर करते हैं।
विलयन की सांद्रता
किसी विलयन का संघटन उसकी सांद्रता से व्यक्त किया जा सकता है। सांद्रता को गुणात्मक रूप से या मात्रत्मक रूप से व्यक्त किया जा सकता है। उदाहरणार्थ, गुणात्मक रूप से हम कह सकते हैं कि विलयन तनु है (अर्थात् विलेय की अपेक्षाकृत बहुत कम मात्र) अथवा यह सांद्र है (अर्थात् विलेय की अपेक्षाकृत बहुत अधिक मात्र) परंतु वास्तविकता में इस तरह का वर्णन अत्यधिक भ्रम उत्पन्न करता है। अतः विलयनों का मात्रत्मक रूप में वर्णन करने की आवश्यकता होती है।
विलयनों की सांद्रता का मात्रत्मक वर्णन
विलयनों की सांद्रता का मात्रत्मक वर्णन हम कई प्रकार से कर सकते हैं:
- (i) द्रव्यमान प्रतिशत (w/w)
विलयनों के अवयवों को द्रव्यमान प्रतिशत में निम्न प्रकार से परिभाषित किया जाता है:
अवयव का द्रव्यमान % = {(विलयन में उपस्थित अवयव का द्रव्यमान) / (विलयन का कुल द्रव्यमान)} × 100 - (ii) आयतन प्रतिशत (v/v)
आयतन प्रतिशत को निम्न प्रकार से परिभाषित किया जाता है-
अवयव का प्रतिशत आयतन = {(अवयव का आयतन) / (विलयन का आयतन)} ×100 - (iii) द्रव्यमान-आयतन प्रतिशत (w/v)
एक अन्य इकाई (मात्रक) जो औषधियों व फार्मेसी में सामान्यतः उपयोग में आती है। वह है 100 mL विलयन में घुले हुए विलेय का द्रव्यमान। - (iv) पार्ट्स पर (प्रति) मिलियन (ppm)
जब विलेय की मात्र अत्यंत सूक्ष्म हो तो सांद्रता को पार्ट्स पर मिलियन (ppm) में प्रदर्शित करना उपयुक्त रहता है:
पार्ट्स पर (प्रति) मिलियन = {( अवयव के भागों की सख्ंया) / (विलयन में उपस्थित सभी अवयवों के कुल भागों की सख्ंया)} ×10⁶ - (v) मोल-अंश
x को सामान्यतः मोल-अंश के संकेत के रूप में उपयोग करते हैं और x के दाईं ओर नीचे लिखी हुई संख्या उसके अवयवों को प्रदर्शित करती है:
अवयव का मोल-अंश = {(अवयव के मोलों की संख्या) / (सभी अवयवों के कुल मोलों की सख्ंया)} - (vi) मोलरता
एक लीटर (1 क्यूबिक डेसीमीटर) विलयन में घुले हुए विलेय के मोलों की संख्या को उस विलयन की मोलरता (M) कहते हैं।
मोलरता (M) = (विलेय के मोलों की संख्या) / (विलयन का लीटर में आयतन) - (vii) मोललता
किसी विलयन की मोललता (m) 1 kg विलायक में उपस्थित विलेय के मोलों की संख्या के रूप में परिभाषित की जाती है और इसे निम्न प्रकार से व्यक्त करते हैं:
मोललता (m) = (विलेय के मोलों की संख्या) / (विलायक का किलोग्राम में द्रव्यमान)
कक्षा 12 रसायन विज्ञान अध्याय 1 एमसीक्यू उत्तर सहित
दिए गए ताप पर एक सांद्र विलयन के परासरण दाब की तुलना
निम्नलिखित में से कौन-सा कथन गलत है?
हेनरी स्थिरांक KH का मान
0.02 M NaCl के 4L जलीय विलयन को एक लिटर जल मिलाकर तनुकृत किया गया। परिणामी विलयन की मोलरता है:
कक्षा 12 रसायन विज्ञान अध्याय 1 के महत्वपूर्ण प्रश्न उत्तर
स्पष्ट कीजिए कि 1 मोल NaCl को एक लिटर जल में मिलने पर जल के क्वथनांक में वृद्धि क्यों होती है, जबकि एक लिटर जल में एक मोल मेथिल ऐल्कोहॉल घोलने पर जल का क्वथनांक कम हो जाता है।
NaCl एक अवाष्पशील विलेय है। फलतः जल में NaCl को मिलाने से जल का वाष्प दाब कम हो जाता है। परिणामस्वरूप जल का क्वथनांक बढ़ जाता है। वहीं दूसरी ओर मेथिल ऐल्कोहॉल जल की तुलना में अधिक वाष्पशील है। अतः इसे मिलाने से विलयन के ऊपर कुल वाष्प दाब बढ़ जाता है अतः जल का क्वथनांक कम हो जाता है।
हेनरी नियम स्थिरांक, KH, की सार्थकता क्या है?
हेनरी नियम स्थिरांक KH का मान जितना उच्च होगा द्रव में गैसों की विलेयता उतनी ही कम होगी।
पर्वतीय क्षेत्रें में हिम आच्छादित सड़कों को साफ करने में नमक का छिड़काव किस प्रकार सहायता करता है। इस प्रक्रिया से संबंधित परिघटना की व्याख्या कीजिए।
जब हिमाच्छादित सड़कों पर नमक का छिड़काव किया जाता है तो सतह से हिम का पिघलना प्रारंभ हो जाता है क्योंकि जल के हिमांक में अवनमन होता है तथा यह सड़कों को साफ करने में सहायता करता है।
कक्षा 12 रसायन विज्ञान अध्याय 1 से बोर्ड परीक्षा में कितने अंकों के प्रश्न पूंछे जाते हैं?
CBSE द्वारा वर्ष 2025-26 के लिए जारी पाठ्यक्रम के अनुसार अध्याय 1 से 7 अंक तक के प्रश्न पूंछे जायेंगे। इस प्रकार परीक्षा की दृष्टि से यह अध्याय महत्वपूर्ण है। छात्रों को पाठ 1 के सभी गणनात्मक प्रश्नों का भी अभ्यास अच्छी तरह से करना चाहिए।
छात्र कक्षा 12 रसायन विज्ञान अध्याय 1 को किस प्रकार से अच्छी तरह से तैयार कर सकते हैं?
छात्रों को पाठ 1 से सम्बंधित सभी महत्वपूर्ण सूत्रों तथा अभिक्रियाओं को उदाहरणों के माध्यम से समझकर पाठ को तैयार करना चाहिए। इन प्रश्नों पर आधारित अतिरिक्त प्रश्नों का अभ्यास भी पूरे पाठ को समझने के लिए अतिआवश्यक है।
कक्षा 12 रसायन विज्ञान अध्याय 1 के लिए अध्ययन सामग्री कहाँ से प्राप्त करें?
तिवारी अकादमी वेबसाइट और ऐप में कक्षा 12 रसायन शास्त्र के पाठ 1 के एनसीईआरटी समाधान के साथ-साथ अध्ययन सामग्री भी निःशुल्क उपलब्ध है जो हिंदी और अंग्रेजी माध्यम के छात्रों के लिए मददगार है।