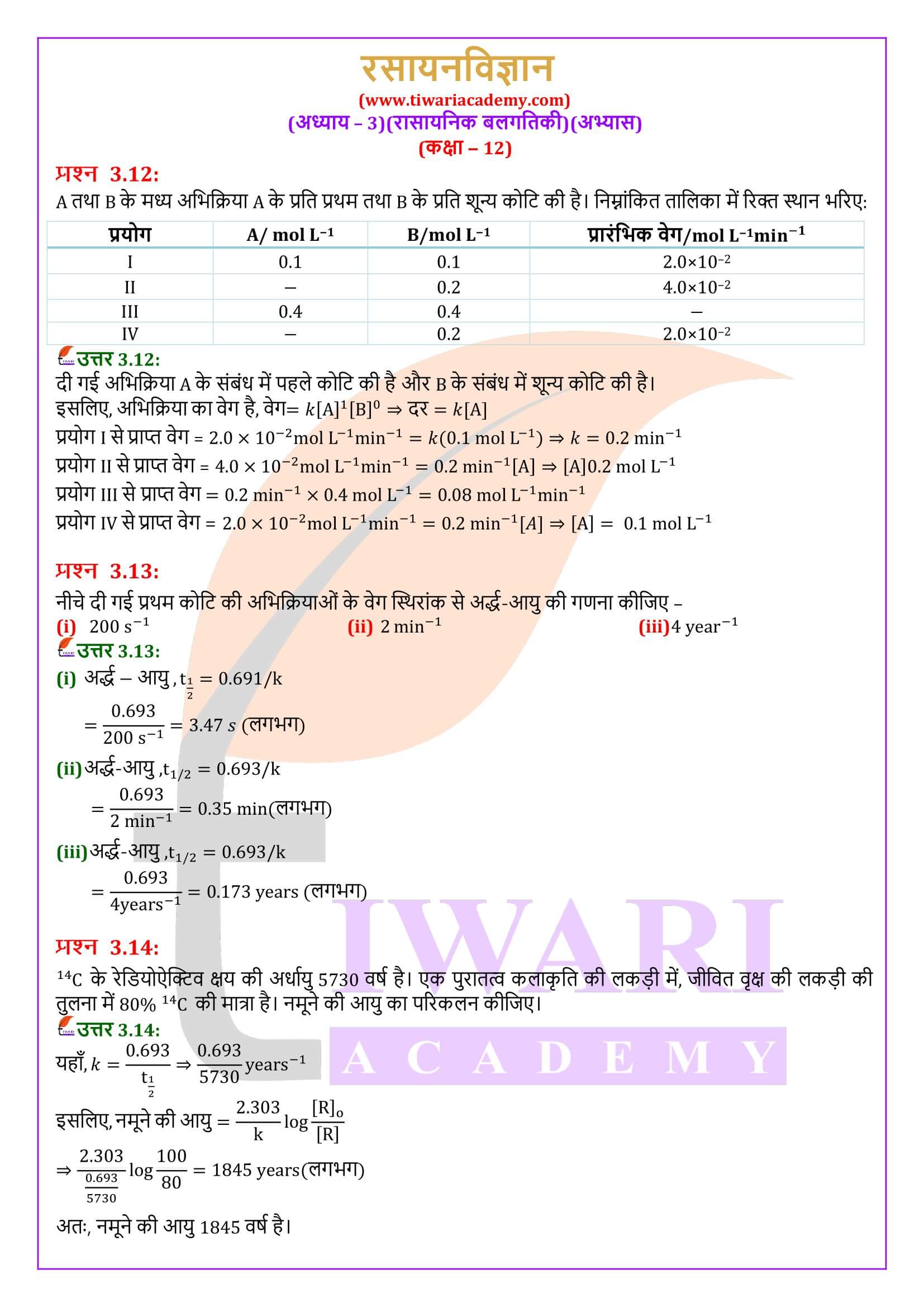
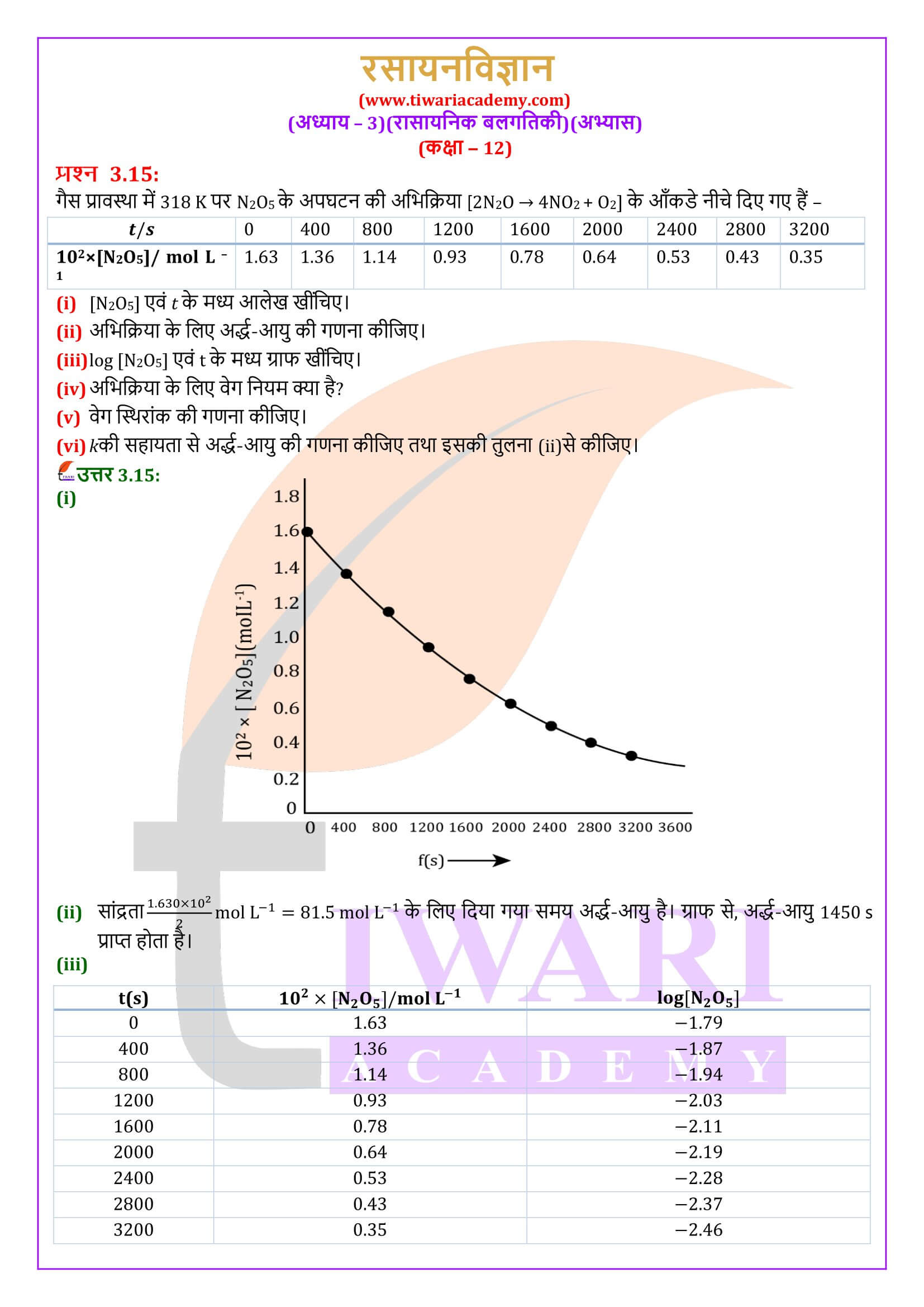
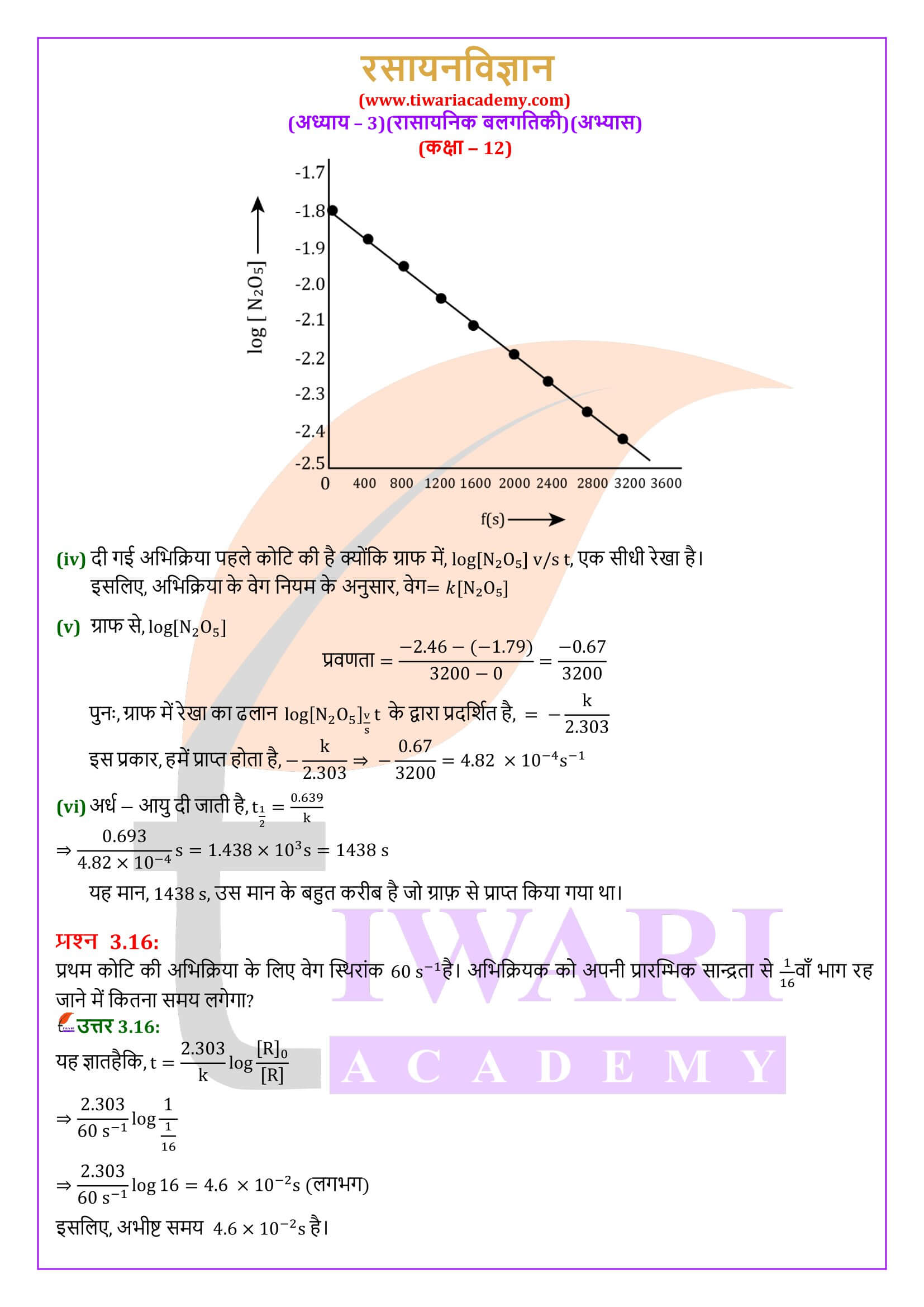
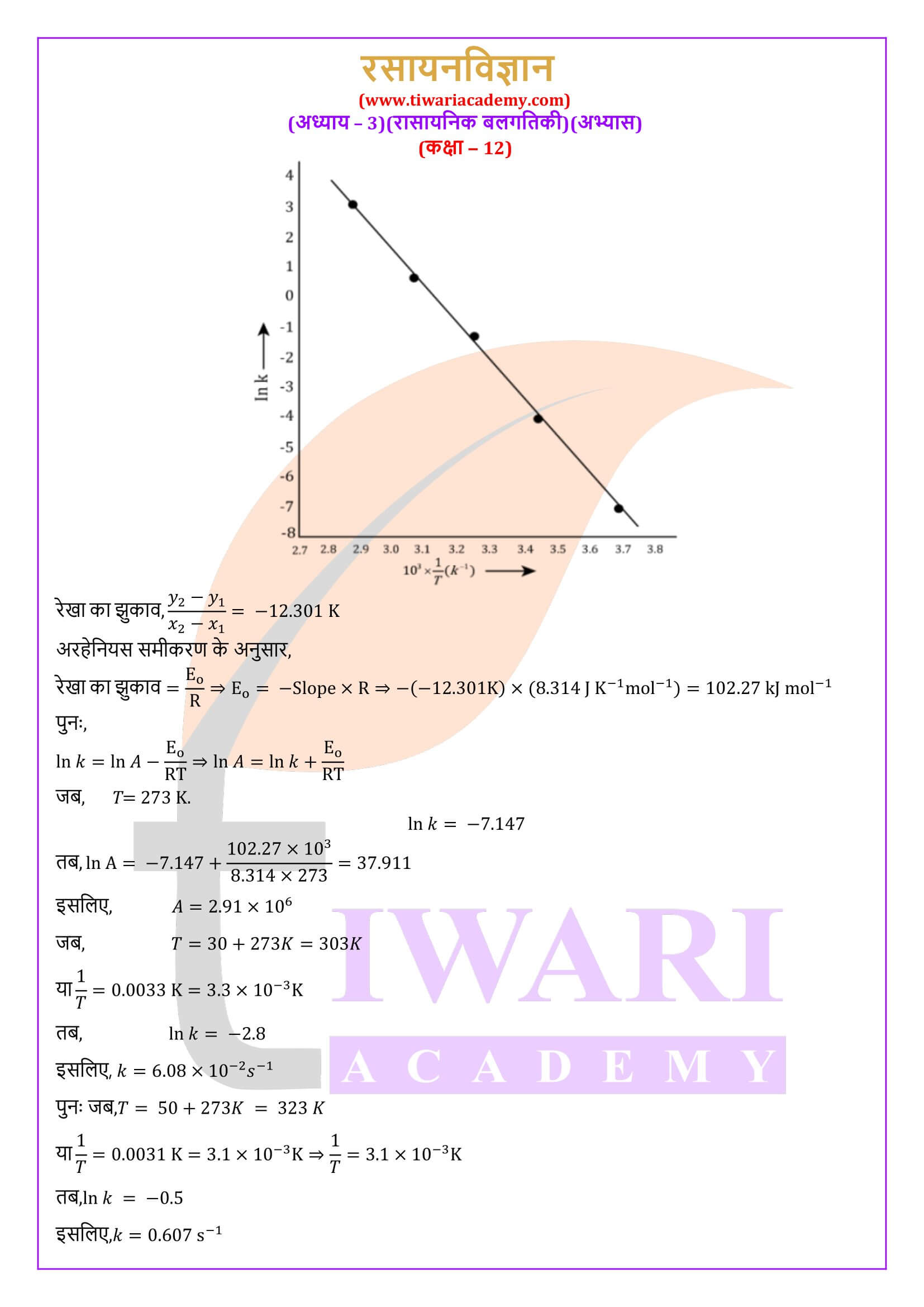
एनसीईआरटी समाधान कक्षा 12 रसायन अध्याय 3 रासायनिक बलगतिकी
एनसीईआरटी समाधान कक्षा 12 रसायन विज्ञान अध्याय 3 रासायनिक बलगतिकी के अभ्यास में दिए गए प्रश्नों के हल हिंदी और अंग्रेजी माध्यम में सत्र 2025-26 के लिए यहाँ से प्राप्त कर सकते हैं। कक्षा 12 रसायन शास्त्र पाठ 3 के प्रश्न उत्तर सीबीएसई तथा राजकीय बोर्ड दोनों के लिए उपयोगी हैं।
एनसीईआरटी समाधान कक्षा 12 रसायन अध्याय 3
कक्षा 12 रसायन विज्ञान अध्याय 3 रासायनिक बलगतिकी के प्रश्न उत्तर
रासायनिक बलगतिकी
रसायन विज्ञान की वह शाखा जिसमें अभिक्रिया वेग तथा इसकी क्रियाविधि का अध्ययन किया जाता है, रासायनिक बलगतिकी कहते हैं। रासायनिक बलगतिकी अभिक्रिया की गति बताती है।
उदाहरण:
ऊष्मागतिकीय आँकड़े दर्शाते हैं कि हीरे को ग्रैफाइट में परिवर्तित किया जा सकता है परंतु वास्तव में इस परिवर्तन की गति इतनी मंद होती है कि परिवर्तन बिल्कुल भी परिलक्षित नहीं होता।
रासायनिक अभिक्रिया के वेग को निर्धारित करने वाले कारक
कुछ कारक जैसे सांद्रता, ताप, दाब तथा उत्प्रेरक अभिक्रिया के वेग को प्रभावित करते हैं।
कक्षा 12 रसायन विज्ञान अध्याय 3 बहुविकल्पीय प्रश्न उत्तर
उत्प्रेरक परिवर्तित करते हैं:
उत्प्रेरक की उपस्थिति में, अभिक्रिया के दौरान ऊष्मा का अवशोषण अथवा उत्सर्जन
रासायनिक अभिक्रिया की सक्रियण ऊर्जा को निर्धारित किया जा सकता है:
अभिक्रिया की कोटि के बारे में कौन-सा कथन सही नहीं है?
रासायनिक अभिक्रिया वेग
इकाई समय में क्रियाकारक या क्रियाफलों की सान्द्रता में हुए परिवर्तन को अभिक्रिया वेग कहते है। अभिक्रिया वेग की इकाई mol L⁻¹ s⁻¹ है।
उदाहरण:
कुछ अभिक्रियाएं, जैसे आयनिक अभिक्रियाएं अत्यधिक तीव्र गति से होती हैं। उदाहरणार्थ, सिल्वर नाइट्रेट के जलीय विलयन में सोडियम क्लोराइड का जलीय विलयन मिलाने पर सिल्वर क्लोराइड का अवक्षेपण अतिशीघ्र होता है। दूसरी ओर कुछ अभिक्रियाएं बहुत मंद होती हैं, जैसे- वायु व आर्द्रता की उपस्थिति में लोहे पर जंग लगना। कुछ अभिक्रियाएं ऐसी भी होती हैं जो मध्यम वेग से होती हैं, जैसे- इक्षु-शर्करा का प्रतिलोमन तथा स्टार्च का जलअपघटन।
कक्षा 12 रसायन विज्ञान अध्याय 3 एमसीक्यू उत्तर
निम्नलिखित में से कौन-सा कथन सही है?
अभिक्रिया A + 2B ⟶ C के लिए निम्नलिखित वेग नियम प्राप्त होता है। वेग = 𝜅[A][B], A की सांद्रता स्थिर रखते हुए अभिक्रियक B की सांद्रता दुगनी करने पर वेग नियतांक का मान
रासायनिक अभिक्रियाओं के संघट्ट सिद्धांत के संबंध में निम्नलिखित में से कौन-सा कथन गलत है?
उत्प्रेरक के लिए निम्नलिखित में से कौन-सा कथन सही नहीं है?
अभिक्रिया वेग को प्रभावित करने वाले कारक
अभिक्रिया वेग प्रायोगिक परिस्थितियों, जैसे- अभिक्रियकों की सांद्रता (गैसों के संदर्भ में दाब), ताप तथा उत्प्रेरक पर निर्भर करता है।
अभिक्रिया की कोटि
किसी अभिक्रिया के वेग नियम व्यंजक में प्रयुक्त सांद्रताओं के घातांकों का योग उस अभिक्रिया की कोटि कहलाती है। अभिक्रिया की कोटि 0, 1, 2, 3 अथवा भिन्नात्मक भी हो सकती है। अभिक्रिया की कोटि के शून्य होने का अर्थ है कि अभिक्रिया वेग अभिक्रियकों की सांद्रता पर निर्भर नहीं करता।
कक्षा 12 रसायन विज्ञान अध्याय 3 महत्वपूर्ण प्रश्न उत्तर
A + B ⟶ उत्पाद, अभिक्रिया के लिए वेग नियम है – दर = 𝜅[A][B]3/2। क्या यह अभिक्रिया एक प्रारंभिक अभिक्रिया है?
एक प्राथमिक अभिक्रिया के दौरान, अभिक्रिया करने वाले अणुओं की संख्या को आण्विकता कहते हैं। यदि यह प्राथमिक अभिक्रिया होती तो B के संदर्भ में अभिक्रिया की कोटि एक होनी चाहिए थी, परन्तु दिए गए वेग व्यंजक में B के संदर्भ में यह 3/2 है। इससे यह प्रदर्शित होता है कि अभिक्रिया प्राथमिक अभिक्रिया नहीं है।
अभिक्रिया में अणुओं के बहुत बड़े अंश की ऊर्जा देहली ऊर्जा से अधिक है फिर भी अभिक्रिया वेग बहुत कम है, ऐसा क्यों है?
ऊर्जा की दृष्टि के अतिरिक्त, प्रभावी संघट्ट के लिए संघट्टकारी अणुओं को एक उपयुक्त अभिविन्यास में होना चाहिए। इस प्रकार की परिस्थिति अभिक्रिया में प्राप्त नहीं हो रही होगी।
सामान्यतः, अभिक्रिया के दौरान अभिक्रिया वेग घटता क्यों है?
अभिक्रिया का वेग अभिक्रियकों की सांद्रता पर निर्भर करता है। जैसे-जैसे अभिक्रिया आगे बढ़ती है, अभिक्रियक उत्पाद में परिवर्तित होने लगते हैं, अतः अभिक्रियकों की सांद्रता कम होती जाती है। फलतः अभिक्रिया-वेग घटता जाता है।
अभिक्रिया की आण्विकता
प्राथमिक अभिक्रिया में भाग लेने वाली स्पीशीज (परमाणु, आयन अथवा अणु) जो कि एक साथ संघट्ट के फलस्वरूप रासायनिक अभिक्रिया करती हैं, की संख्या को अभिक्रिया की आण्विकता कहते हैं। जब अभिक्रिया में केवल एक स्पीशीज संलग्न हो तो अभिक्रिया एक अणुक कहलाती है, उदाहरणार्थ- अमोनियम नाइट्राइट का अपघटन: NH₄NO₂ ⟶ N₂ + 2H₂O
अभिक्रिया वेग की ताप पर निर्भरता
किसी रासायनिक अभिक्रिया में 10° ताप वृद्धि से वेग स्थिरांक में लगभग दुगुनी वृद्धि होती है।
छात्र कक्षा 12 रसायन अध्याय 3 को किस प्रकार से अच्छी तरह से तैयार कर सकते हैं?
छात्रों को पाठ 3 से सम्बंधित सभी महत्वपूर्ण अभिक्रियाओं, परिभाषाओं और उनके उदाहरणों के नोट्स बनाकर समझते हुए याद करना चाहिए। अध्याय के अंत में दिए गए प्रश्नों से अपने ज्ञान को समय-समय पर आंकते रहना चाहिए। पाठ्यनिहित प्रश्नों को भी ध्यान से लिखित रूप में हल करना चाहिए तथा अभ्यास में दिए गए सभी प्रश्नों को हल करके पाठ को अच्छी तरह से समझना चाहिए।
कक्षा 12 रसायन विज्ञान बोर्ड परीक्षा में अध्याय 3 से कितने अंकों के प्रश्न पूंछे जाते हैं?
सीबीएसई द्वारा वर्ष 2025-26 के लिए जारी पाठ्यक्रम के अनुसार 12वीं कक्षा रसायन अध्याय 3 से लगभग सात अंकों के प्रश्न पूछे जा सकते हैं। इस प्रकार हम कह सकते हैं कि परीक्षा की दृष्टि से यह अध्याय महत्वपूर्ण है। छात्रों को सभी इस अध्याय से संबंधित अतिरिक्त प्रश्नों को भी अच्छी तरह से तैयार करने के लिए यहाँ दिए गए पठन सामग्री को अवश्य डाउनलोड करें।
बारहवीं कक्षा रसायन शास्त्र में पाठ 3 के कौन-कौन से पहलु परीक्षा की दृष्टि से महत्वपूर्ण हैं?
कक्षा 12 रसायन शास्त्र पाठ 3 में रासायनिक अभिक्रिया वेग तथा इसके उदाहरण, इससे सम्बंधित संख्यात्मक प्रश्न, अभिक्रिया के वेग को प्रभावित करने वाले कारक, अभिक्रिया की कोटि, आण्विकता तथा अभिक्रिया वेग की ताप पर निर्भरता संबंधी सभी पहलुओं पर ध्यान देना चाहिए। छात्र प्रत्येक विषय-वस्तु के अधिक अभ्यास के लिए अतिरिक्त पठन सामग्री का प्रयोग कर सकते हैं।